热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
背景介绍:缺氧从异常肿瘤血管,过度肿瘤细胞增殖和异常淋巴系统产生是在几乎所有实体瘤中常见的恶性现象。根据之前的研究,肿瘤缺氧已被证明是肿瘤治疗失败的重要原因之一。特别是对于放射疗法,氧气是杀死肿瘤的活性氧的产生所必需的元素。因此,低氧肿瘤微环境通常是放疗抵抗的重要原因。肿瘤通常是低氧的,这限制了当前肿瘤疗法的功效,尤其是放射疗法,在该疗法中氧气对于促进辐射诱导的细胞损伤至关重要。全氟化碳,一组的化学惰性的优异的生物相容性合成的分子,已被广泛研究或在临床用于各种目的,包括人造血液替代,器官保存,超声成像和氟磁性成像中使用。
本论文研究人员通过利用全氟化碳(PFC)促进红细胞渗透的能力,开发了一种简单而有效的两阶段氧气输送策略,以使用PFC纳米颗粒调节缺氧肿瘤的微环境。
Unisense微电极系统的应用
将4 mL制备好的PFTBA HSA纳米颗粒或媒介物(32 mg/mL HSA)存储在无菌氧气室中(O 2流量=5 L/min),进行PFC氧合1分钟。使用Unisense氧气微电极测量溶液中的氧气浓度。
实验结果
发现PFTBA全氟化碳纳米粒子可以通过物理溶解的氧增加RBC的渗透和O 2递送。建立了一个两阶段的O 2的PFTBA作为氧气载体,PFC被封装到白蛋白中,并且在没有高氧呼吸的情况下静脉注射到荷瘤小鼠中。在肿瘤中积累后,PFC纳米颗粒迅速释放了物理溶解在PFC中的氧气,这是氧气输送的第一阶段。然后,PFC随后促进了红细胞浸润,进一步释放了O 2作为氧输送的第二阶段。与应用两阶段氧气输送系统后的赋形剂相比,对乳腺癌放射治疗(SUM149PT)的肿瘤生长率从40%降低至14%。对于低氧结肠癌(CT26),肿瘤的生长率也从30%降低到15%。此研究工作提供了一种简单但有效的方法来逆转肿瘤缺氧,从而逆转肿瘤对放射疗法的抵抗力。PFTBA HSA显示出未来临床过渡的巨大希望,因为包括PFTBA和白蛋白在内的所有药物均可在临床上获得,并且已被证实无毒。

图1、两阶段氧气输送系统的示意图。静脉注射后,PFTBA HSA的纳米颗粒在肿瘤部位积累由于EPR效应和释放物理结合直径(1ST阶段氧供应)。同时PFTBA可以有效抑制肿瘤血管中的血小板活化,破坏维持良好的肿瘤血管屏障,从而导致RBC(红细胞)的浸润增加以及RBC在肿瘤中的氧输送(第二阶段氧供应)。
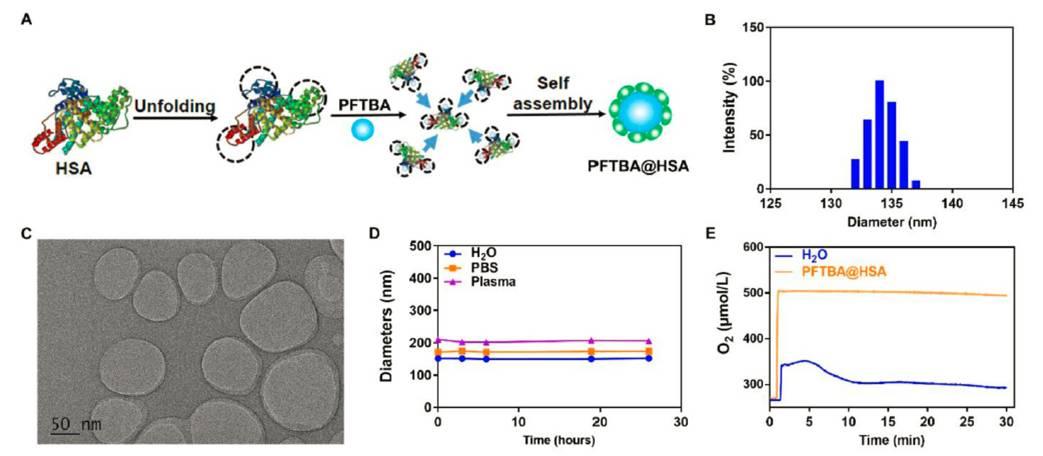
图2、PFTBA HSA的合成及特征。(A)展开自组装方法的示意图。首先通过切断二硫键暴露白蛋白的疏水区域,然后与全氟化碳自组装以形成PFTBA HSA纳米颗粒。(B)通过动态光散射检测的PFTBA HSA直径。(C)PFTBA HSA的TEM图像。(D)PFTBA HSA与以下不同溶液混合的稳定性:H 2 O,PBS和血浆。(E)在1个大气压下O 2吸附的PFTBA HSA的氧释放曲线。
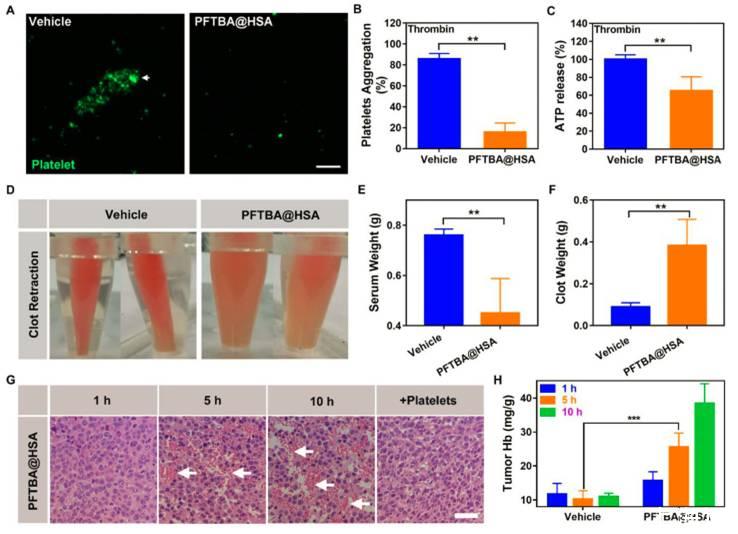
图3、PFTBA HSA对血小板功能和红细胞浸润的影响。(A)在媒介物或PFTBA HSA存在下被凝血酶激活的血小板聚集的代表性图像。白色箭头表示血小板聚集的位置;比例尺=50μm。(B)凝血酶诱导的血小板凝集。将数据计算为活化前后的吸光度比(n=6)。(C)ATP从凝血酶激活的血小板中释放(n=6)。(D)凝块缩回的代表性照片。(E)定量血清重量(n=8)。(F)凝结重量的定量(n=8)。(G)PFTBA HSA处理的肿瘤切片在不同时间的H&E染色。白色箭头表示RBC;比例尺=25μm。(H)赋形剂或PFTBA HSA给药后血红蛋白的定量(n=6)
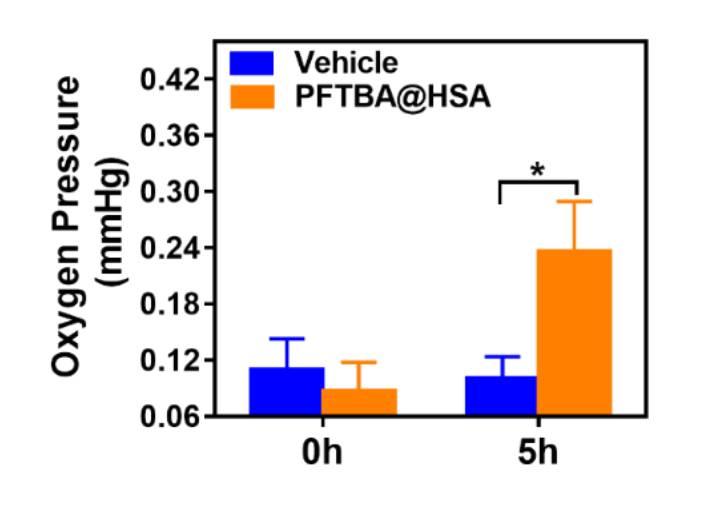
图4、使用氧微电极探针定量检测CT26肿瘤内氧浓度(n=7),数据以均数±标准差表示。
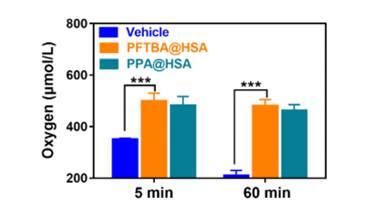
图5、应用氧气微电极在1个大气压下PFC HSAs的氧结合能力,数据显示取平均值±标准差。
结论与展望
氧气是杀死肿瘤活性氧的产生所必需的元素。因此低氧肿瘤微环境通常是放疗抵抗的重要原因。尽管有不同的策略已经提出了相反的肿瘤缺氧和获得更好的结果放疗,但仍没有良好的氧供体又是可供临床使用,以减轻肿瘤缺氧。全氟化碳是一组的化学惰性的优异的生物相容性合成的分子,它们的高氧溶解度,全氟化碳已被广泛探索作为氧供应商加大放射治疗或光动力学疗法的治疗结果。研究人员以全氟三丁胺(PFTBA)具有所有全氟化碳化合物中最强的血小板抑制作用。利用PFTBA的血小板抑制作用,以白蛋白为载体,建立了一个两阶段的O 2递送系统PFTBA HSA。其中PFTBA HSA纳米颗粒或媒介物在溶液中释放氧浓度的性能是通过unisense氧气微电极测试完成的,unisense氧气微电极能够快速的测试出溶液中氧浓度的微小变化,从而能够全面了解全氟化碳PFTBA纳米颗粒调节氧的性能。该研究工作提出了一种简单而有效的方法来逆转肿瘤缺氧对放疗的抵抗力,提出了关于两阶段供氧可快速缓解缺氧性肿瘤的微环境,有效提高放疗疗效。临床上已证明了研究中使用的所有物质的安全性,确保可以将该简单策略快速,轻松地转化为临床应用来解决与肿瘤缺氧相关的临床问题。