热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
在哺乳动物中,颈动脉体是响应急性缺氧而驱动呼吸、交感神经活动和血压的主要氧传感器。因此与控制呼吸的脑干神经元网络不同,在没有颈动脉体的情况下,主要受急性缺氧抑制,交感神经网络必须强烈兴奋。然而,中央交感神经氧传感器的分子和细胞特性在很大程度上尚未得到解决。一些研究已经确定了下丘脑和脑干中的缺氧兴奋细胞,包括孤束核(NTS)和延髓腹外侧(RVLM)。虽然氧传感机制尚未完全解决,但它们可能涉及星形胶质细胞、血红素加氧酶(H2O)、Nap通道和/或腺苷5‘-单磷酸活化蛋白激酶。然而,脑干和下丘脑中氧传感器的存在并不排除脊髓也对氧敏感的可能性。利用人工原位灌注和整块制剂来克服先前体内研究的局限性。我们确认脊髓交感神经节前神经元对氧敏感,并描述了确定其敏感性、关键功能、细胞特性和机制的实验。利用人工原位灌注和整块制剂来克服先前体内研究的局限性。本研究确认了脊髓交感神经节前神经元对氧敏感,并描述了确定其敏感性、关键功能、细胞特性和机制的实验。
Unisense微电极系统的应用
首先对实验老鼠使用了原位双灌注制剂。小鼠在去脑、迷走神经切断和去内脏的准备中,包括脑干、颈椎和胸脊髓在内的中枢神经系统通过降主动脉逆行灌注。通过颈总动脉用单独的管线灌注颈动脉体。手术后这种原位脑干-脊髓准备物被固定在背侧,颅骨和小脑被移除以暴露第四脑室。Uniesne的Clark型PO2微电极(尖端直径为25μm,以减少组织损伤;时间常数小于1秒)和极谱放大器(Unisense)用于脑干的可达性来原位测量CNS组织PO2测试。降低微电极直至尖端接触到老鼠第四脑室表面,微电极用来穿透组织的深度为100um,然后将微电极的尖端带到400到800微米的深度,获得氧分压浓度。整体切片组织PO2使用Clark型PO2微电极(unisense)。在每组实验之前和之后在用于灌注的相同组成的盐水中校准氧气微电极。降低微电极直到尖端接触切片表面,在失去与灌注液湍流相关的P O 2波动时识别。然后将微电极尖端降低到组织中100μm的深度。
实验结果
研究揭示了新的分子和细胞机制,这些机制具有足够的敏感性和功效,有助于大脑的主要氧气防御机制。因此SOS可能有助于支持自私大脑假说,该假说假设交感神经活动增加和由此产生的高血压的主要作用是维持足够的脑血管灌注。研究数据强烈表明SSPN作为氧传感器。SSPN非常适合这项任务:它们对氧高度敏感,是任何中枢交感神经中继中最直接和最不依赖突触的,并且几乎支配身体的每个末端器官和血管。
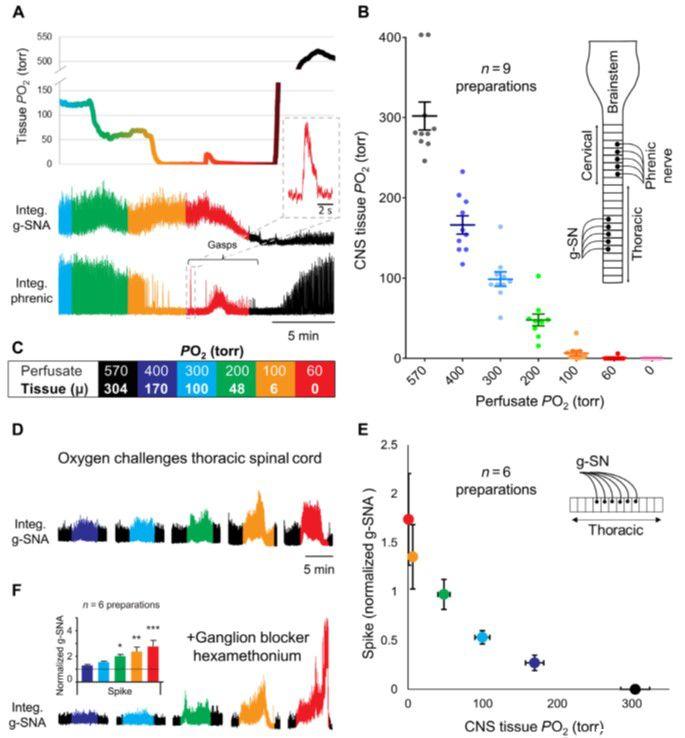
图1、脊髓的氧敏感性保持在原位。(A和B)双灌注原位制备,颈动脉体和中枢神经系统(CNS)(脑干和脊髓)隔室独立灌注,证明灌注PO2和CNS组织之间的关系磷。使用Clark型极谱微电极(尖端直径,<25μm)测量脑干中的中枢神经系统组织氧合,而中央灌注液的氧合从570到60-torr PO2逐渐降低(PCO2保持在40 torr)以5分钟步进递减。颈动脉体灌注液始终保持恒定。随着CNS的PO2进入生理范围,当CNS的PO2严重缺氧时。(C)颜色编码框总结了灌注液PO2和平均(μ)组织PO2之间的关系.(D和E)原位胸脊髓准备证明g-SNA和(B)中建立的组织PO 2之间的关系.g-SNA标准化为50托的组织PO 2近似于体内CNS常氧。(F)g-SNA反应在存在神经节阻滞剂六甲铵(100μM)的情况下在原位脊髓制备中持续存在,这表明氧敏感性不依赖于交感神经链内的突触连接。
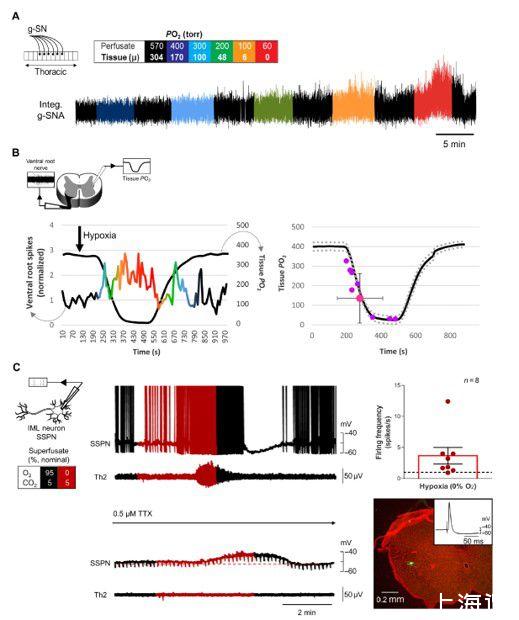
图2、新生儿在原位灌注的胸脊髓和整块横向胸脊髓切片制剂中对缺氧的交感神经反应。(A)记录新生儿(P2)g-SNA在单次灌注胸脊髓原位制备中对缺氧的反应(左上角示意图)。减少灌注液PO2会增加g-SN活性。方框:颜色编码说明了以托为单位的灌注液P O 2。曲线下的幅度和/或面积表示活动水平。(B)使用Clark型微电极的IML组织P O 2测量,尖端低于组织表面100μm,对侧腹神经记录来自整块横向胸脊髓切片制备(左上角示意图)。作为组织PO2在14种制剂中的8种中,腹神经活动减少,腹神经活动增加。P O 2阈值响应(如上定义)发生在140±121托(n=8)。(C)整体制剂中的单个IML SSPN(全细胞)和腹根神经活动(T2)。在1分钟的峰值响应期间,发射率增加了3.67±1.32峰值/秒(n=8)。在TTX中,缺氧使神经元去极化3.1±0.98 mV(重复测量单向ANOVA;基线与缺氧,P=0.03;缺氧与冲洗,P=0.01;n=10)但对膜电阻没有影响(1049±29兆欧;重复测量单向方差分析,P=0.5;n=10)。
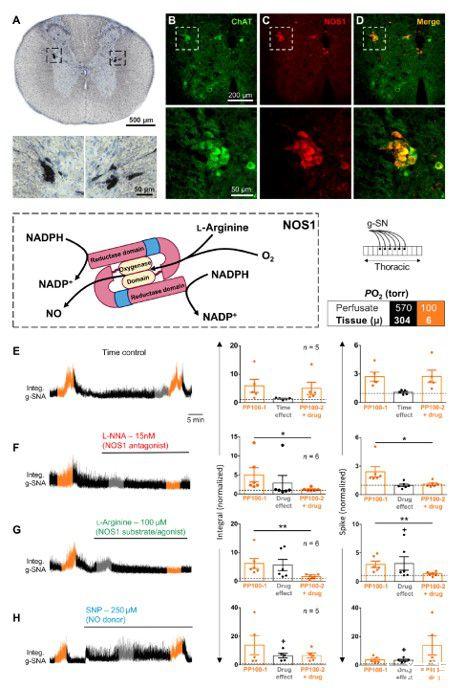
图3、NOS1在SOS中的作用。(A)大鼠胸脊髓IML中NOS1的过氧化物酶免疫组化。(B和C)小鼠胸脊髓中NOS1(红色)和ChAT(绿色)的双荧光免疫组化。(D)合并NOS1和聊天标记。IML(虚线方块)在底部面板中被放大。(E到H)框:颜色编码说明灌注液的PO2。左:大鼠原位胸脊髓制剂中g-SNA对缺氧的反应(见示意图)。在1分钟间隔内测量低氧反应(灌注液和组织PO 2,分别为100和~6 torr)和药物效应,反应最大,分别以橙色和灰色表示。右:分组数据。(F)L-NNA、NOS1阻断剂;(G)L-精氨酸,NOS1激动剂;(H)SNP,不依赖NOS的NO供体。
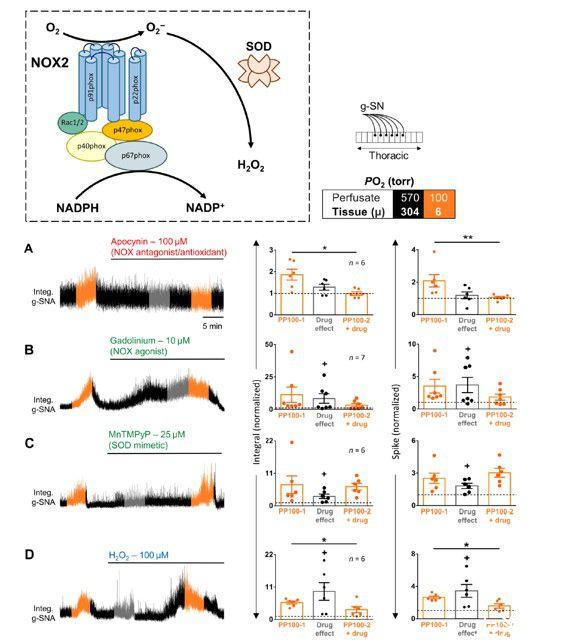
图4、NOX和ROS在SOS中的作用。方框颜色编码说明了以torr为单位的灌注液PO2。左:大鼠原位胸脊髓制剂中g-SNA对缺氧的反应(见示意图)。在1分钟间隔内测量低氧反应(灌注液和组织PO2,分别为100和~6 torr)和药物效应,分别以橙色和灰色表示。右:分组数据。A夹竹桃麻素、NOX抑制剂;(B)钆、NOX激动剂;(C)MnTMPyP,SOD模拟物;(D)H2O2,活性氧。
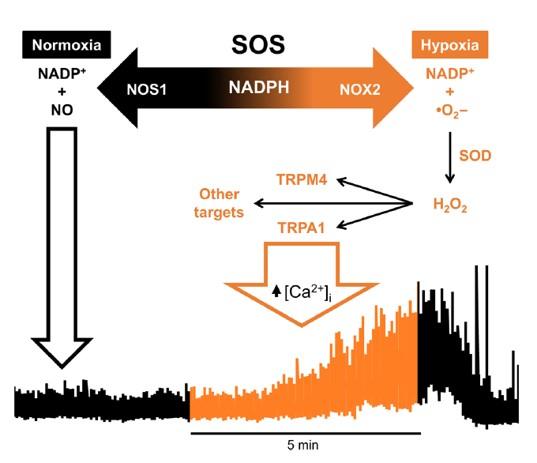
图5、SOS氧传感机制模型。两种酶NOS1(神经元NOS)和NOX2竞争共同底物NADPH。NOS1在IML中非常丰富,并作为PO2依赖的NADPH。当PO2下降时,NADPH可用性增加,增加NOX2活性并产生超氧化物(·O2)和H2O2。ROS激活包括TRPA1和TRPM4在内的多种受体,增加细胞内钙和SSPN活性。该模型意味着需要剩余量的氧气来维持NOX产生ROS和SOS响应;即使组织P O 2为零保持,SOS失败。
结论与展望
血液氧合减少(低氧血症),哺乳动物会产生心肺反应,增加重要器官的氧气。颈动脉体是呼吸的主要氧化学感受器,但交感神经介导的心血管对缺氧的反应持续存在,这表明存在额外的高保真氧传感器。本论文研究表明脊髓胸交感神经节前神经元因缺氧而兴奋并因高氧而沉默,与周围的星形胶质细胞无关。这些脊髓氧传感器(SOS)增强了由CNS窒息样刺激引起的交感呼吸活动,表明它们具有生死攸关的优势。数据表明SOS使用的机制涉及神经元一氧化氮合酶1(NOS1)和烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶(NOX)。研究人员建议NOS1作为高氧中NADPH的氧依赖性水槽。在缺氧情况下,NOS1对NADPH的分解代谢减少,增加了NADPH对NOX的可用性,并启动了活性氧依赖性过程,包括瞬时受体电位通道激活。配备这种机制,SOS可能对慢性疾病、脊髓损伤和心肺危象的生理调节具有广泛的重要性。
 相关新闻
相关新闻