热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
肿瘤是一种常见疾病,严重威胁着人类的健康和生命。在我国,恶性肿瘤是导致死亡的主要疾病,发病率逐年增高。肿瘤的发生、发展与免疫力低下密切相关。免疫系统无时不刻在监视着体内的细胞。如果有细胞变异、变性,免疫系统会立即进行处理;而如果免疫力弱、免疫系统有缺陷,会没有能力及时处理,会有不少“漏网之鱼”,癌细胞就悄无声息地发展起来了。
如何提早发现?如何取得更好的治疗效果?在研究过程中,都少不微电极的帮助。下面是微电极在医学肿瘤研究领域的相关应用论文。
论文1、全氟碳通过调节肿瘤内环境来提高低氧类药物的疗效
研究背景:大多数肿瘤在生长过程中会出现不同程度的乏氧,而乏氧是导致肿瘤转移和耐受的重要原因之一。因此,在肿瘤治疗中,清除乏氧肿瘤细胞对预防肿瘤复发和转移尤为重要。乏氧依赖性药物则是在乏氧条件下起效的一类物质,主要包括乏氧性细菌、乏氧性前药(如:沙门氏菌、替拉扎明)等。这些物质可与其他抗肿瘤手段联合,清除乏氧肿瘤细胞,防止肿瘤复发和转移。然而,临床上联合乏氧依赖性药物对肿瘤的疗效并不理想,这主要是由于肿瘤的乏氧部位渗透性差,药物浓度过低所导致的。尽管已经有一些手段可增加乏氧药物的渗透性,然而,渗透性增加必然伴随着氧气浓度增加,反而降低了乏氧药物的疗效。研究人员发明了一种全氟化碳纳米材料,该纳米材料可通过光动力效应破坏血管,增加肿瘤部位的药物渗透,同时作为一种“吸氧海绵”,将渗透进入肿瘤组织的氧气,富集并消耗完毕,为乏氧依赖性药物创造了能够起效的乏氧微环境。实验结果显示,通过本设计的全氟化碳纳米粒可显著增加乏氧药物的疗效。更重要的是,研究采用的全氟化碳纳米粒对机体的组织器官没有毒性,安全可靠,极有可能成为全氟化碳在临床应用的一个新方向。
微电极研究系统的应用:
Unisense氧微电极-OX-25测量了纳米粒子材料水中受到激发后对应的溶液中的氧浓度变化,以及该纳米材料注入老鼠体内后,测量老鼠体内肿瘤组织的氧分压浓度的变化情况。
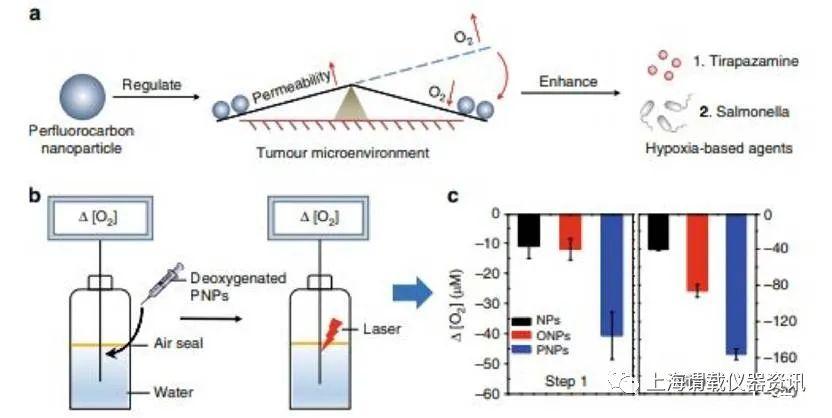
图1、PNP介导的改善HBAs和O2吸收及消耗的原理图
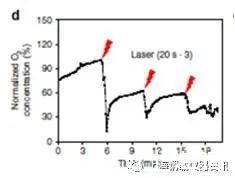
图2、老鼠的肿瘤组织内给药后,三个周期的激光照射(808 nm,2Wcm-2)后肿瘤内的溶解氧(DO)实时变化
论文2、Mg-Ag-Y合金对MG63骨肉瘤细胞系肿瘤生长和转移的作用机制及机制评价
研究背景介绍:骨肉瘤是一种恶性原发性骨肿瘤,常伴有肺转移。骨肉瘤的根治性手术通常需要骨内植入物。因此应开发具有抗肿瘤功能的种植体。镁及其合金具有良好的生物降解性能,是一种极具潜力的骨科材料成骨能力和抗肿瘤特性。然而随着它们不受控制的降解速度和未知的抗肿瘤机制的问题出现了。研究发现与纯Mg相比,稀土银中掺钇(Ag-Y)能极大地提高这些元素的耐蚀性,从而使MG-1Ag-1Y合金具有更好的耐蚀率。研究证实了Mg和Ex-Mg-1Ag-1Y合金均表现出对局部肿瘤生长和肺转移的抵抗作用,可通过改变细胞外酸中毒微环境、提高Mg浓度、抑制C-X-C趋化因子受体4型(CXCR4)水平、增加前列环素(PGI2)合成来实现。我们的研究表明,Ex-Mg-1Ag-1Y合金具有较好的耐腐蚀性和抗肿瘤特性,是一种很有前途的骨科植入物。
微电极研究系统的应用:
使用pH微电极穿刺入老鼠的组织中测量老鼠植入金属材料周围的组织内的pH值,测试周期为操作步骤完成后每4天,即分别在第0天、第8天、第16天和第36天完成测试。
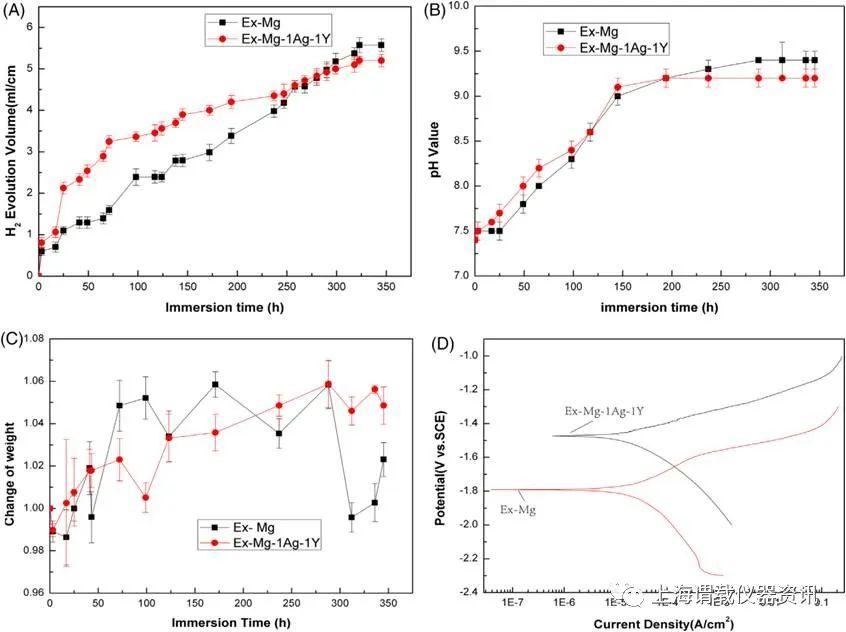
图1、Mg-1Ag-1Y合金和Mg移植体样品在1×PBS中动态降解随时间变化的曲线图:(a)析氢体积,(B)1×PBS的pH值,(C)试样重量变化,(D)电位的动态极化曲线图。
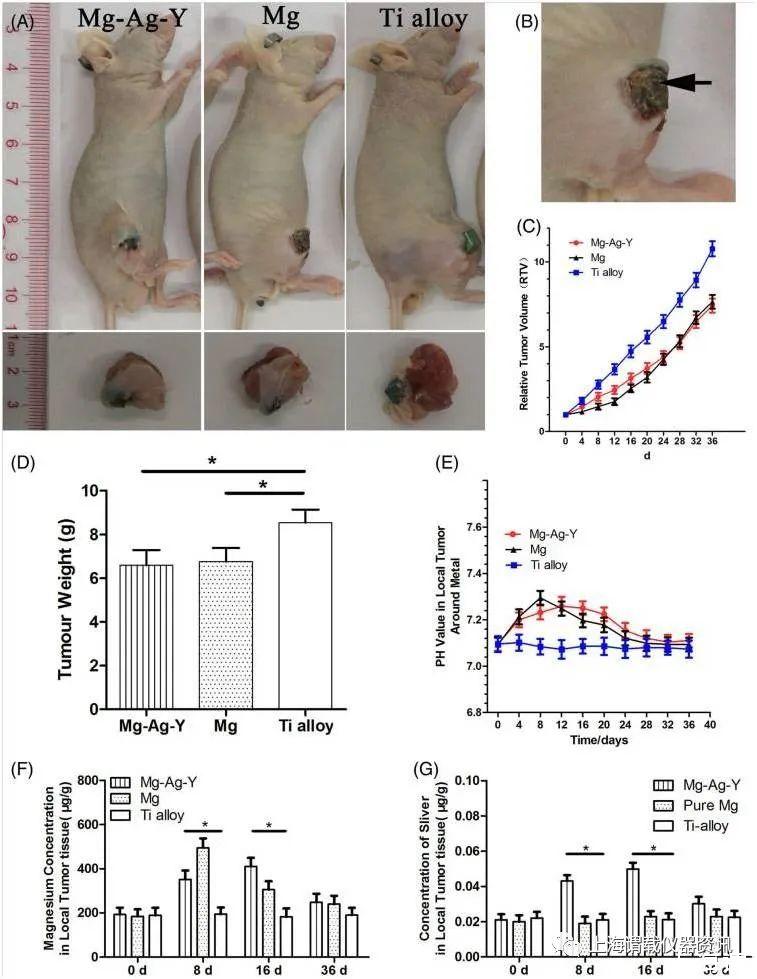
图2、A:裸鼠经前Mg-1ag-1y合金、纯Mg、Ti合金原位植入5周后,肉眼观察后肢局部肿瘤。B:放大局部肿瘤,在Ex-g-1Ag-1Y合金和纯Mg(黑色箭头)植入物表面可见纤维包膜。(C)三组不同时间点局部肿瘤周围的RTV曲线和pH值。D:植入不同金属材料的裸鼠处死后取肿瘤重量。E:术后第0天、第8天、第16天、第36天局部肿瘤组织中镁的含量。G:术后第0天、第8天、第16天、第36天肿瘤组织银(Ag)水平。
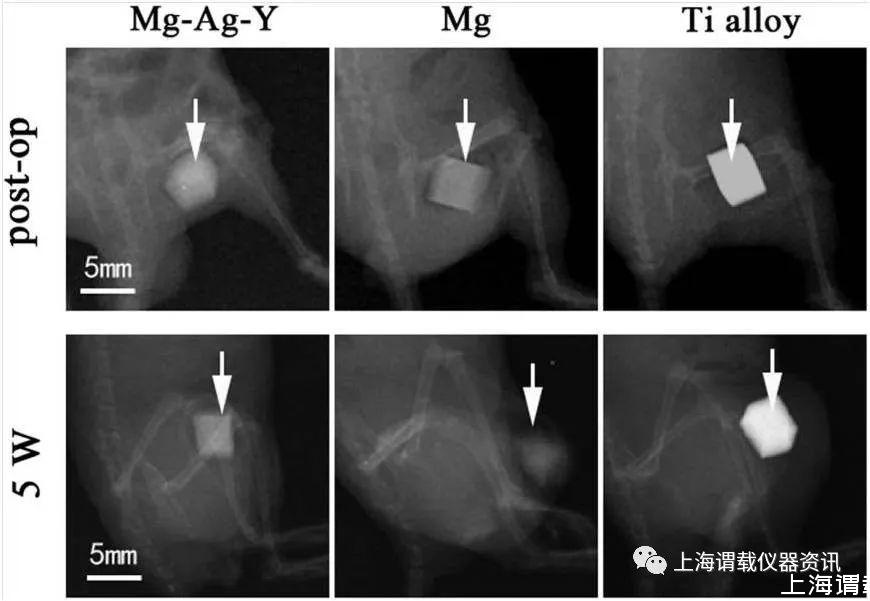
图3、三组小鼠后肢在不同时间点的x线成像。白色箭头表示植入金属。
论文3、pH响应型氧纳米微气泡用于低氧肿瘤的自发氧传递
研究背景:缺氧是大多数实体肿瘤中非常常见的现象,其特点是血管密度降低、血管几何形状不规则、氧梯度不一致。肿瘤缺氧是导致肿瘤耐化疗治疗的重要因素,尤其是在需要氧气杀死癌细胞的光动力治疗和放疗中。氧传递剂如氧饱和的全氟碳纳米乳和脂质氧微纳米气泡已被用于超声激活缺氧肿瘤供氧。这种供氧系统仍然存在一些缺陷,包括过早的供氧和依赖外部刺激。为了解决这些局限性,研究人员开发了由缩醛化葡聚糖聚合物外壳包裹的氧气纳米微气泡,以响应肿瘤微环境中pH值的微小下降而自发地产生氧气。乙酰化的葡聚糖聚合物外壳作为一个强大的屏障,防止循环血液中的气体溶解,以保留大部分的氧负载,其ph响应特性使氧在温和的酸性肿瘤微环境中突然释放。所得的葡聚糖氧纳米气泡具有良好的稳定性和生物相容性。使用氧气微电极对老鼠的体内外实验研究了pH反应性氧释放过程,研究了醋酸化右旋糖酐纳米气泡对体外无刺激氧供应的影响。
微电极研究系统的应用:
在超声成像的指导下,将氧气微电极插入老鼠的肿瘤组织内,通过直接测量瘤内氧水平来评估纳米气泡的氧传递和瘤内氧水平的增强。用氧微电极传感器记录特定时间间隔注射氧纳米微气泡后后3小时肿瘤内氧分压(pO2)。
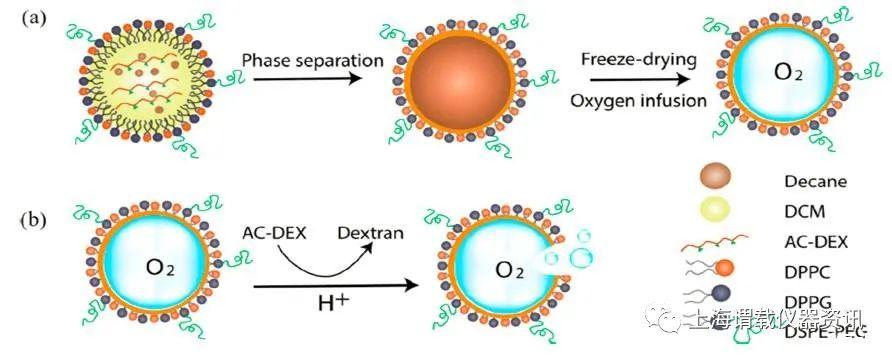
图1.pH响应型氧纳米微气泡制备和pH触发型氧释放剂的示意图。图a表示的是以AC-DEX为外壳制备ph响应型纳米气泡。将含有AC-DEX和癸烷的二氯甲烷溶液在由DPPC、DPPG和dsp-peg组成的脂质溶液中乳化,制备纳米乳剂。在相分离、冷冻干燥和输氧之后,就形成了氧纳米微气泡。图b表示的是水溶性葡聚糖中AC-DEX的酸催化水解在酸性环境中pH引发纳米微气泡的氧释放。
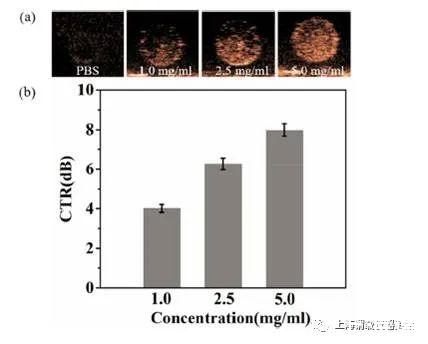
图2、氧纳米气泡的体外超声成像。(a)不同浓度的氧纳米泡溶液的超声图像(b)图中超声图像的组织对比(CTR)
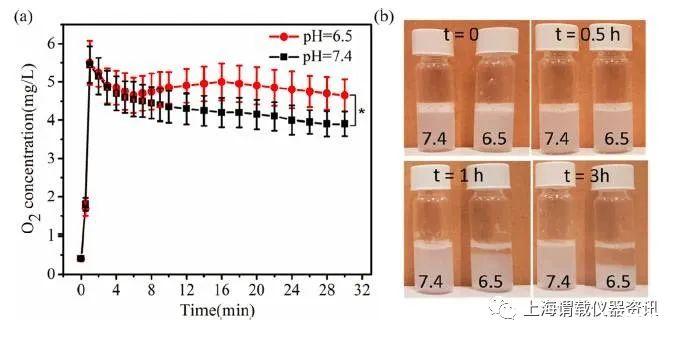
图3、a)在pH 6.5和7.4下培养的氧纳米微气泡的体外氧释放动力学,(b)储存在中性溶液(pH 7.4)和酸性溶液(pH 6.5)中3小时的氧纳米微气泡的样品照片。
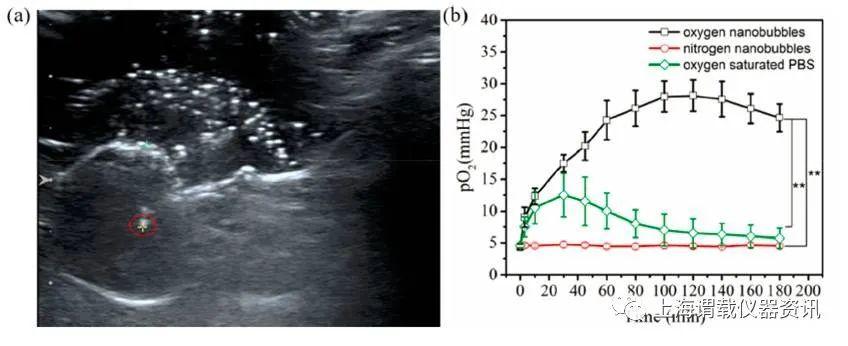
图4、CNE2荷瘤小鼠肿瘤内pO2测定。a)超声图像显示的是一个氧微电极传感器插入肿瘤组织内,氧微电极传感器的尖端的位置是由红色圆圈中的黄色十字符号表示。b)老鼠静脉注射含氧纳米微气泡物质、含氮纳米气泡物质和含氧饱和PBS缓冲液后3小时瘤内pO2变化的测量。
论文4、硅化镁纳米颗粒作为癌症饥饿治疗的脱氧剂
研究背景介绍:众所周知,肿瘤在人体内生长过程中,需要形成自身的血管网络用于提供肿瘤组织生长必需的氧气分子和营养成分,因此“血管”就是肿瘤的“命门”;通过破坏或阻塞肿瘤的血管,就能切断对肿瘤组织的血供,肿瘤必然死亡。由于“肿瘤饥饿疗法”对无机材料的苛刻要求(如满足肿瘤组织的特异性、耗氧能力强、阻塞血管持久性,可注射性、良好的生物相容性等要求),目前无机材料用于肿瘤饥饿疗法还无法实现。中科院上海硅酸盐研究所施剑林研究员与华东师范大学化学与分子工程学院步文博教授研究团队合作,采用改进的自蔓延燃烧法,成功制备了单分散、直径约100nm的硅化镁(Mg2Si)纳米耗氧剂,经聚乙烯吡咯烷酮(PVP)表面改性后形成稳定的溶胶,赋予其良好的可注射性。该研究从采用自蔓延燃烧方法合成新型Mg2Si纳米颗粒出发,揭示了肿瘤微环境可以特异性激活Mg2Si纳米颗粒的耗氧功能和分解产物堵塞肿瘤血管的新现象,开创性提出了无机耗氧剂用于肿瘤饥饿疗法的新思路,为传统的肿瘤饥饿疗法注入了新活力。
微电极研究系统的应用:
Unisense氧气微电极测试了老鼠体内静脉中血液中的氧气浓度以及老鼠体内肿瘤组织的氧气浓度。其中老鼠静脉血液是从老鼠尾静脉抽出20ul的静脉血液后,并立马进行血液中氧气浓度的测试。而老鼠体内的各个器官组织氧气浓度是通过使用氧微电极穿刺测试得到的。
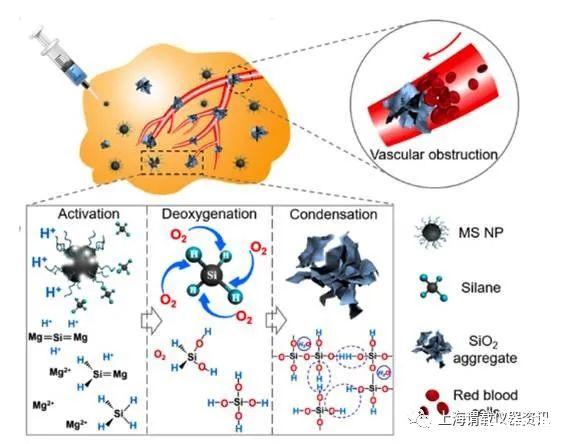
图1、肿瘤饥饿疗法示意图

图2、测试老鼠活体的体内组织在不同时间以及不同距离内的氧浓度装置图。
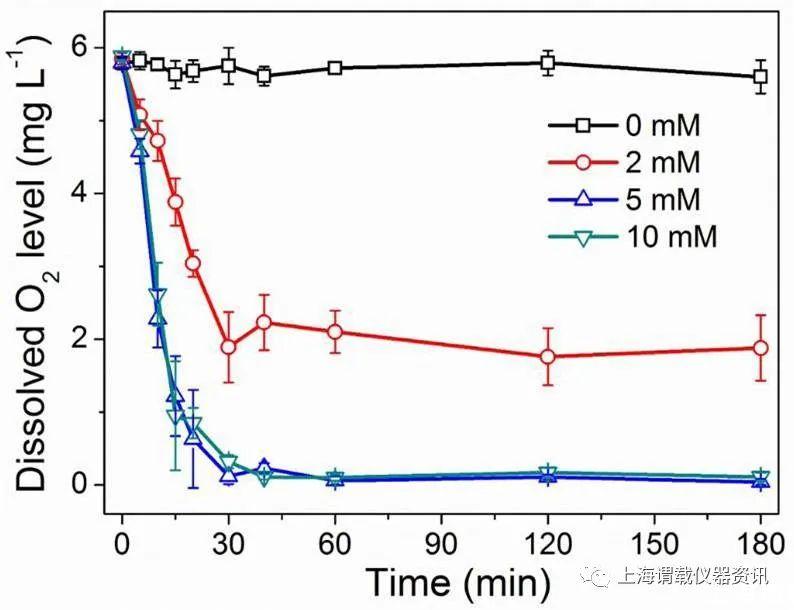
图3、酸化的DMEM营养基中(pH=6.5)加入不同浓度(0 mM、2mM、5mM、10mM)的脱氧剂MS-NPS后,体系中氧气浓度随时间的变化情况。从图中可以看出,脱氧剂MS-NPS加入会引起体系中的氧气浓度迅速降低,在30分钟后,体系中的氧气浓度就处于平衡了,而脱氧剂MS-NPS的浓度越大,体系中的氧气浓度越小。但是当脱氧剂浓度增加到一定浓度时(10mM),其氧气浓度就几乎不变了。
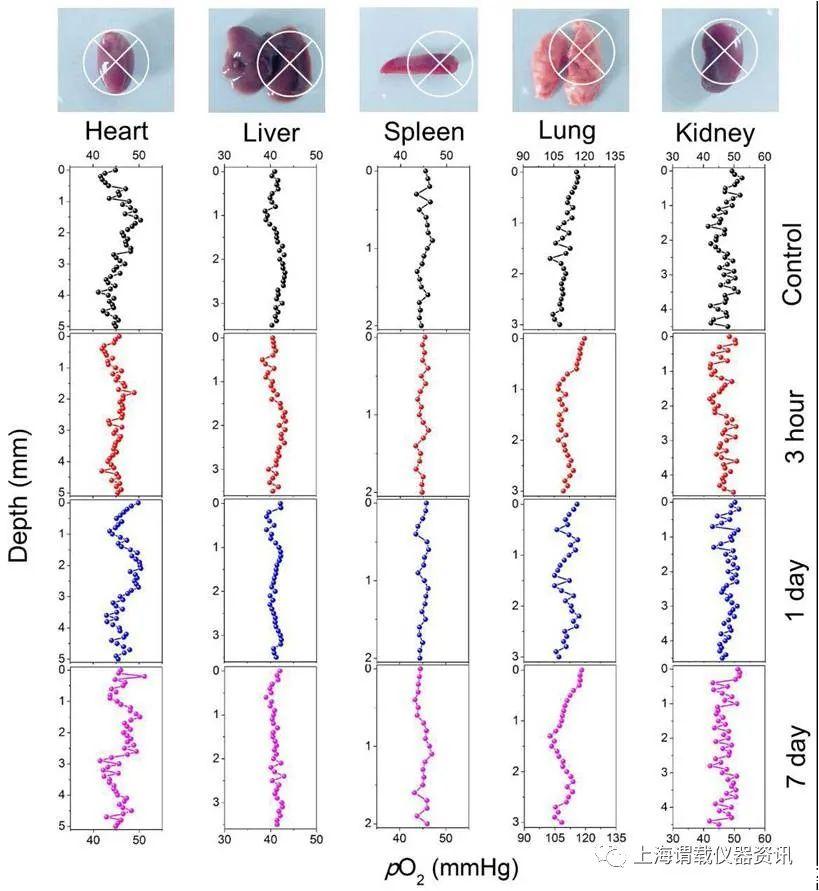
图4、小鼠中注射高剂量MS NPs(100mg/L)和未注射MS NPs不同组织器官(心脏、肝、脾脏、肺、)的在不同时间段微表面氧分压剖面分析图。从图中可看出,老鼠各器官组织中的氧分压值未出现较大的波动。
 相关新闻
相关新闻