热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
中枢神经系统(CNS)非常容易受到损害时,当其血液供应会受到损害。因此CNS具有许多控制系统以确保充足的血液供应。去甲肾上腺素(NA)和多巴胺产生广泛的血管收缩,从而有效地节省了血液用于通过神经血管扩张耦合局部活性区域。虽然单独AADC活性不足以对5-HT的内源性合成(实际上血管缺乏5-HT SCI后14,23,24),AADC可以直接合成痕量胺,例如色胺和酪胺,来自色氨酸和酪氨酸等氨基酸。中枢神经系统CNS血流被认为是由小动脉的平滑肌细胞(SMC)来控制该紧勒响应于血管活性物质,包括中央衍生的5-HT和NA作用于5-HT 1和α2-肾上腺素能受体,通过发生在周边类似机制。小动脉分支形成没有SMC的小毛细血管,但与环绕CNS毛细血管的稀疏间隔的周细胞相关。
虽然周细胞具有不同的功能,包括脊髓损伤后促进疤痕形成,许多周细胞是收缩,含平滑肌α肌动蛋白(α-SMA)和收缩响应于单胺。事实上,周细胞最近已显示出在两个控制正常CNS血流中起主要作用,并缺血性中风的响应。研究人员发现到当SADC后毛细血管中的AADC上调时,其在周细胞中的表达最为强烈。因此本论文研究人员通过微电极探索了周细胞是否通过合成取代丢失的单胺的TA来在SCI后调节毛细血管张力和血流中起特殊作用。
操作步骤
unisense光学氧电极测量了正常无损伤和SCI大鼠体内的氧浓度。老鼠首先进行麻醉,椎板切除术和立体定向稳定与上述脊髓血管成像的设置相似。用光学氧微电极传感器(Unisense)测量老鼠脊髓液中氧气的分压(pO2),该传感器尖端直径为50μm,并涂有荧光团,当用610 nm红光激发时,发出780 nm红外光其强度与附近的氧气浓度成比例地变化,从而淬灭了该光(其中1μM O2=0.62 mmHg pO 2;)。unisense克拉克型氧气为微电极传感器安装在微操纵器上,以将微电极尖端垂直推进到脊髓背侧表面。尖端穿透脊膜,然后深入到背角和腹角的灰质中,或者使脊膜凹陷而不会穿透背角(<200μm)。两种氧分压的测试方法均获得相似的pO2测量值。采用微电极尖端穿透脊膜方法造成较小的局部损坏,因此是较好的原位测试老鼠脊髓内氧分压的方法。
实验结果
广泛释放的血管收缩(血管紧张)是由脑干神经元细胞释放的单胺5-羟色胺和去甲肾上腺素引起的,而局部血管的扩张是由谷氨酸能神经元的活性引起的。检测了血管紧张度如何适应大鼠脊髓损伤(SCI)后神经元衍生的单胺的丢失。研究发现在实施脊髓损伤数月后,由于单胺受体(5-HT 1的反常过量活性)损伤部位下方的脊髓处于慢性缺氧状态。在周皮细胞上,尽管没有单胺,这种单胺受体活性导致周细胞局部收缩毛细血管,从而将血流减少至缺血水平。在不存在单胺的情况下,受体活化是由异位表达芳香族-1-氨基酸脱羧酶(AADC)的周细胞产生痕量胺(例如色胺)造成的,后者直接从饮食氨基酸(例如作为色氨酸)。抑制单胺受体或AADC,甚至增加吸入氧,可使脊髓损伤后的运动神经和运动功能得到显著缓解。
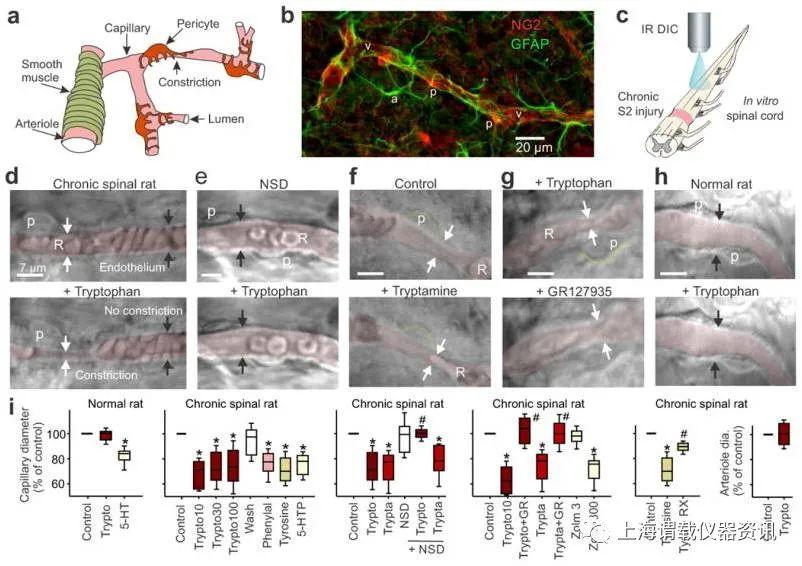
图1、脊髓损伤后痕量胺会收缩毛细血管。(a)脊髓血管系统示意图。(b)免疫标记脊髓毛细血管(v)和尾巴至SCI部位的星形胶质细胞(GFAP,a)上的周皮细胞(NG2,p)。(c)微分干涉显微镜(DIC)设置的示意图,用于在脊髓损伤后对脐带皮层表面以下的毛细血管成像。(d)顶部,慢性IC骨横断的尾椎脊髓毛细血管的DIC图像,RBC(R)和内腔伪彩色为红色(箭头指向内皮)。底部,应用色氨酸(30μM)会引起与周细胞(p)相邻的局部性局部血管收缩(白色箭头;开始于应用后1分钟),但在缺乏周细胞的区域中则不会(黑色箭头)。(e)与d相同,但在色氨酸之前使用AADC抑制剂(NSD1015[NSD];300μM),以防止产生色胺。(f)色胺的应用模仿了色氨酸诱导的血管收缩(d),与周细胞相邻(绿色轮廓)。(g)色氨酸诱导的收缩(顶部,箭头处)被5-HT 1B受体拮抗剂GR127935(3μM;底部)逆转。(h)正常大鼠的毛细血管(上),缺乏色氨酸引起的收缩(下)。

图2、ACI,痕量胺和5-HT 1B受体在SCI后在周细胞中共表达。(a)顶部,在慢性脊髓横断尾段的脊髓横切面用AADC抗体进行免疫标记(黑色,DAB,上图),表明AADC在毛细血管上广泛表达(v),但在动脉上却不表达(a)。底部,在毛细管的纵向切片中显示AADC(红色)和CD13(绿色,周细胞标记)的免疫荧光,显示AADC和CD13在周细胞中的唯一共定位(p;黄色)。(b)左图为内源性色胺(黑色)尾部损伤部位的DAB免疫标记,显示毛细血管(v)的周细胞(箭头)尤其是体细胞中的色胺密集染色。插图显示了较高的毛细管横截面放大图(比例尺,10μm),表明周细胞(p)细胞体和过程对色胺具有染色作用(箭头),而内皮细胞(e)没有(蓝,甲酚-内皮细胞核的紫色染色)。右图为色胺(红色)和CD13(绿色)的免疫荧光染色进一步显示了周细胞中的色胺染色。(C)在用5-HTP(30 mg/kg,腹腔注射,固定前25分钟)预处理后,对AADC产品5-HT和尾部横断损伤的尾周细胞标记NG2进行免疫标记。箭头,NG2标记的周细胞中的5-HT染色。(d)该AADC产品5-HT(红色)显示密集堆积在周细胞细胞体内,并标记有AADC的过程(绿色;箭头)。(e)SCI后周细胞对毛细管的作用示意图,显示色氨酸(红色)从血液扩散到周细胞中,AADC合成色胺(黄色),色胺对附近5HT 1B受体(蓝色)的作用以收缩毛细血管。(f)如面板c和d所示对5-HT进行免疫标记,但未进行5-HTP预处理。(g)对损伤部位尾端的5-HT 1B受体和NG2进行免疫标记。
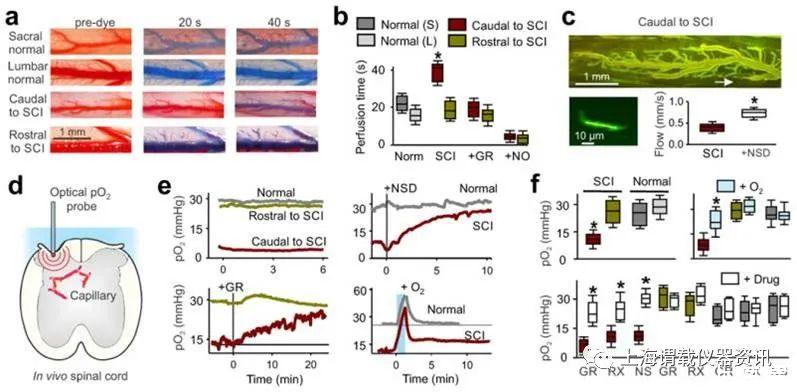
图3、慢性脊髓损伤后血流不足和缺氧。(a)在心内注射亚甲蓝染料(20%于盐水中)之前和之后(20和40 s),正常和慢性脊髓大鼠的骨和腰椎脊髓背脉管系统的体内图像。(b)在受伤和正常的未受伤大鼠的(尾至损伤)或腰部(延髓)的灌注时间,并随5-HT 1B拮抗剂GR127935(GR,30μM局部应用于尾线)发生变化或硝酸钠;n=每组5只鼠,以箱形图表示。(c)体内的双光子显微图像注射FITC-右旋糖酐后spin骨脊髓血管尾部至损伤部位(iv)。箭头指示所成像的脊髓下脊髓毛细血管的位置。计算RBC流量的指示毛细管的左下方,较高的放大倍率和较亮的视图。右下图是慢性脊髓大鼠未经治疗和经NSD1015(NSD)治疗的脊髓(局部给药3 mM)的组毛细血管RBC流速的方框图,每组n=5。(d)脊髓中体内氧气测量(pO 2)的示意图。(e)相比于SCI的延髓缘或正常未受伤大鼠,尾部至慢性SCI的低pO 2(缺氧,红色),以及pO 2的变化扩张与NSD1015或容器之后GR127935(GR,局部30μM),或瞬时高Ô2呼吸(95%氧气2,5%CO2,1分钟)。(f)在用瞬时氧气(95%持续1分钟;在10-20分钟测量),GR127935,RX821002(RX;5μM局部用药)之前和之后未受伤(正常)和受伤大鼠中pO 2的箱形图NSD1015(NS);每个方法中n=5-20,如方法中所述。药物作用在数分钟内达到峰值,并持续10-90分钟(记录峰值)。氧分压2值是指从L4–L6(对受伤或正常腰椎)到S2–S4,Ca1(对损伤或正常aud骨的尾椎)脊段的平均值。*P<0.05,相对于治疗前对照(f)或正常组织(b)有显着差异。
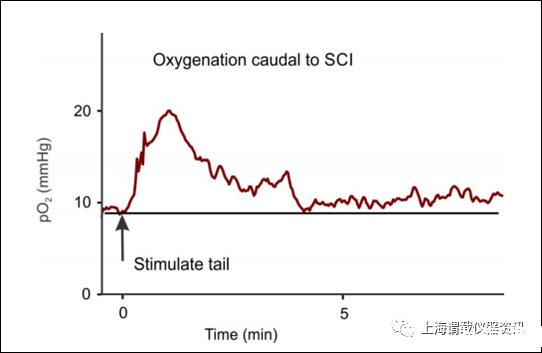
图4、神经血管耦合尾至脊髓损伤。简短的机械刺激尾巴(1秒光沿尾巴摩擦,在箭头处)提供感觉输入到骶脊髓产生,慢性脊髓大鼠的骶管尾部氧合延长至横断(S2横断,伤后2个月)。光学氧气微电极(pO2)由背部的光学传感器(optode)测量S4骶脊髓角。这种氧气的持续增加反映了经典神经血管耦合,通过神经元活动扩张血管并增加氧合。慢性脊髓大鼠明显的神经血管耦合可能有助于解释短暂吸入强化氧后观察到的运动活动(EMG)的延长增加。
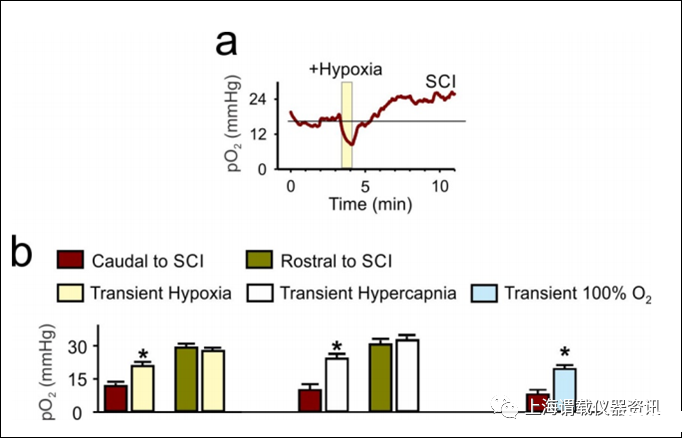
图5、老鼠脊髓损伤(SCI)后低氧、高碳酸或高氧呼吸后,脊髓脊髓的氧合反弹增加。a)用光学氧传感器测量脊髓中氧分压(pO2),慢性脊髓大鼠脊髓的尾部(S2断面,伤后4个月)。b)在基线条件下,脊髓是缺氧的。短暂的低氧呼吸(1分钟呼吸10.5%的氧气,而不是通常的21%的空气)引起pO2的立即下降(在黄条处),可立即引起休克,进一步增加脊髓缺氧。随后pO2增加持续15-20分钟,而其他地方的pO2迅速恢复正常。各组分别为pO2前期(红色、绿色)和15分钟后的短暂缺氧(n=7),高碳酸血症(30 s呼吸10%CO2空气,n=5),或高氧(1 min 100%O2,n=7)呼吸,随着所有治疗的增加,pO2在脊髓尾侧逐渐增加。
结论与展望
本论文探索了周细胞是否通过合成取代丢失的单胺的TA来在SCI后调节毛细血管张力和血流中起特殊作用。研究结果表明了几个新的概念,这些新概念从根本上改变了脊髓损伤后对脊髓功能和康复的理解。脊髓损伤后,周细胞在调节毛细血管张力和脊髓血流中起主要作用;SCI导致毛细血管过度紧张,血液流动不良和缺氧的慢性状态。研究人员发现慢性脊髓缺氧与临床相关的部分脊髓损伤(挫伤)有关,并且通过扩张血管的干预措施(例如,AADC抑制剂)可以实现运动功能的长期改善。在实施脊髓损伤数月后,由于单胺受体(5-HT 1的反常过量活性)损伤部位下方的脊髓处于慢性缺氧状态。在周皮细胞上,尽管没有单胺,这种单胺受体活性导致周细胞局部收缩毛细血管,从而将血流减少至缺血水平。在不存在单胺的情况下,受体活化是由异位表达芳香族-1-氨基酸脱羧酶(AADC)的周细胞产生痕量胺(例如色胺)造成的,后者直接从饮食氨基酸获得。抑制单胺受体或AADC,甚至增加吸入氧,可使脊髓损伤后的运动神经和运动功能得到显著缓解。上述这些研究结果表明,减轻慢性缺氧是一种有希望的SCI康复方法。在对老鼠脊髓液内的原位氧分压测试采用了unisense光学氧电极测试完成的。由于unisense微电极尖端穿透脊膜方法造成较小的局部损坏,因此是一种较好的原位测试老鼠脊髓内氧分压的方法,被医学研究人员广泛应用于动物组织内的氧分压的原位测试。
 相关新闻
相关新闻