热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
神经退行性疾病与神经死亡密切相关,进而导致轴突束退化,导致神经功能丧失。细胞治疗方法的最新发展为增强神经修复功效提供了潜在的可能性。神经干细胞(NSC)具有独特的自我更新和多向分化能力,NSC分化为神经元的效率至关重要,这与实现其在神经退行性疾病治疗中的临床应用相关。
另外,神经营养因子(NF)作为调节神经系统病理的潜在治疗因子受到了极大的关注。电刺激(ES)也被认为是神经损伤的有效治疗方法。为了调节NSC分化的命运决定,微流控平台已广泛用于创建体外神经网络模型。最近的研究在微流控芯片上开发了皮质纹状体网络,从而实现了轴突生长的突触连接。微流体装置的设计目的是分离突触前和突触后区室,这可以允许进入和操纵皮质轴突和纹状体树突之间的形成。此外,基于多微阵列电极(MEA)的生物电子平台允许调制神经元网络和电生理学表征。微阵列电极的主要优点是能够监测神经活动的发育活动和动态响应。最近,多项研究成功证明了MEA与微流控芯片的集成,可以对结构化和可视化的神经网络进行监测。因此,为了更好地观察NSC的轴突再生和神经分化,这将是一个很好的研究方向。
这项研究开发了一种集成微阵列电极的微流控芯片,作为轴突损伤和再生的体外中枢神经系统模型。此外,这项研究中试图探索微流体阵列电极系统中神经突生长与NF和ES协同效应之间的关系。为了实现这一目标,小鼠NSC被用作神经生长的原代细胞模型,并在微流体阵列电极系统中在有和没有NF的情况下进行培养。ES在25 mV下施加1小时。该芯片的设计能够通过分隔的微通道控制神经突的生长和神经细胞的分化。此外,还在微流控阵列电极芯片中证明了NF和ES对神经分化的协同作用。因此,该芯片可能成为研究神经退行性疾病和神经再生的有用工具。
设计原理
微流控阵列电极芯片的制作
制造了基于聚二甲基硅氧烷(PDMS)的微流体装置。微阵列电极(MEA)是通过电子束物理气相沉积制造的。所生产的微流控阵列电极芯片通过注入入口用70%乙醇进行灭菌,并在细胞接种前用磷酸盐缓冲液体清洗。
电化学性能表征
使用双电极电化学系统对微流控阵列电极芯片的电化学性能进行了表征。通过将电极浸入神经分化培养基中5天进行长期稳定性测试来评估电极的稳定性。使用电化学分析仪进行循环伏安法(CV)和电化学阻抗谱(EIS)测量。
免疫细胞化学和成像分析
将微流控阵列电极芯片中培养并固定的细胞洗涤后,通过在DPBS中与3%牛血清白蛋白在室温下孵育3小时,可减少非特异性蛋白质结合。随后,在4°C下用一抗处理细胞与二抗孵育,并对细胞核进行染色。使用倒置共焦激光扫描显微镜获取染色样品的荧光图像。通过Image J软件分析标准化荧光强度和平均神经突长度。
数据介绍
微流控阵列电极芯片的设计
微流控芯片由两个主通道组成:一个用于小鼠神经干细胞培养(左通道),一个用于衍生神经干细胞轴突(右通道)。细胞培养通道和衍生通道通过桥通道相连。如图1所示,微阵列电极由两部分组成,左侧是产生电活动以分化神经干细胞的ES电极,右侧是应用ES的轴突电极。此外,基于PDMS的微流控设备被仔细地排列在微阵列电极平台的顶部,电极专门位于突触前和突触后隔室的下方。铬/金电极是通过在5 nm厚的Cr粘附层上沉积50 nm厚的金制成的。突触前电极(直径30μm)位于轴突微通道左侧以刺激轴突起始段产生动作电位(AP),突触后电极(直径50μm)位于轴突微通道右侧。MEA的微电极排列在基质中,可用于监测神经细胞的胞外电活动。这种带有微阵列电极的微流控芯片既可以分离神经室,也可以使用神经细胞培养重建大脑电路。
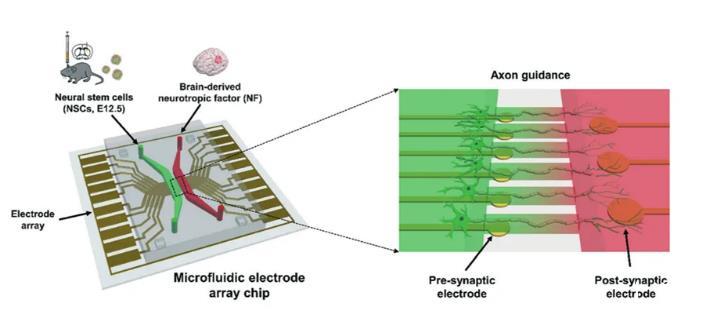
图1微流控阵列电极芯片的实验装置。
微电极的电化学分析
微流体阵列电极芯片中循环伏安法(CV)的电化学表征,证明了明显氧化和还原峰的电极的明确电化学响应(图2A)。CV曲线表明,不带NSC的介质和带NSC的介质之间的阴极电荷存储容量(CSC)不同。电极在不含和含有NSC的神经分化培养基中5天的稳定性结果如图2B所示。计算出的CSC从没有NSC的约45.3 F cm−2增加到有NSC的83.0 F cm−2。此外,具有NSC的介质中的电极的EIS提供了随时间变化的阻抗大小∣Z∣与频率的关系曲线(图2C)。在分化过程中,与对照组相比,在5天的时间内监测电极上形成的汇合细胞层。正如预期的那样,电极的阻抗在100 Hz时以与时间相关的方式增加。这些参数可以提供定义电极失效点的信息,电极失效点是指电极芯片剥离表面上的材料。此外,微通道中的阻抗随时间增加的原因是电极污垢的影响造成的,可以通过吸收而不是溶液产生。
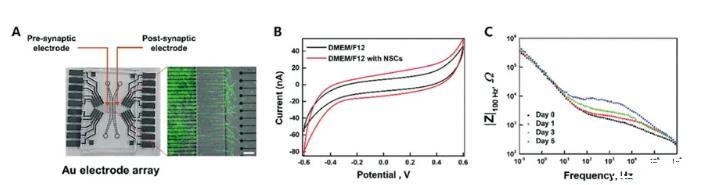
图2微阵列电极的电化学表征。
微流控阵列电极芯片中NSC衍生神经细胞的神经突生长
使用微流控阵列电极芯片上不同范围(0-100 mV)的电参数刺激NSC,以优化ES参数。与未刺激的NSC相比,在微流控芯片中用25 mV刺激NSC可增强其神经突生长。然后,检查了是否可以在微流体阵列电极芯片中监测和量化NF和ES治疗的效果。如图3A所示,证实NSCs在不同条件下5天后分化为具有长神经突的神经细胞。此外,我们发现用NF和ES处理的NSC衍生神经元显示出比其他组显着更长的神经突(p<0.01)(图3B)。接下来,为了量化这些星形胶质细胞或神经标记物的表达水平,我们使用Image J软件对Tuj1或GFAP阳性部分进行图像分析(图3C)。
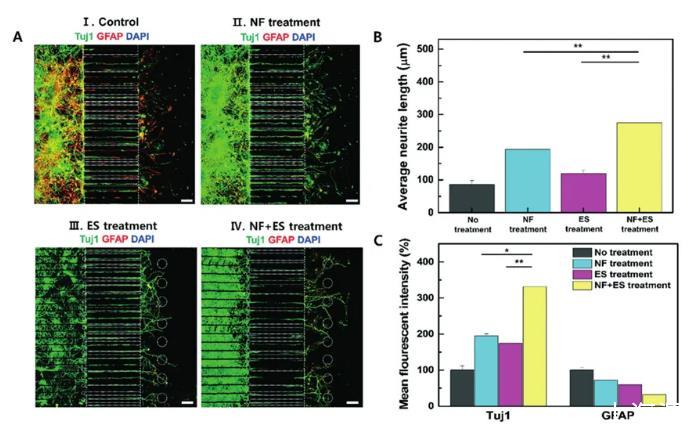
图3微流体阵列电极平台中的轴突生长。
轴突损伤和再生
为了再生医学中未来潜在的治疗应用,测试了微系统是否可用于体外损伤后测定轴突再生。使用抽吸泵将轴突室的轴突取出,并通过单独使用NF或NF和ES治疗来使受损的轴突再生。有趣的是,损伤后3天,NF治疗促进了轴突再生,超出右通道边界线(图4A)。检查了NF与ES治疗一起在3天时对轴突再生的影响(图4B)。形态学分析结果表明,轴突再生后,NF和ES治疗组的平均神经突长度和平均神经丝荧光强度显着高于NF治疗组(图5)。NF+ES治疗组神经元的平均长度为204.3±47.9μm,明显长于NF治疗组(101.9±17.6μm;p<0.01)(图5A)。此外,进一步评估了成熟神经元上的Tuj1和神经丝免疫化学染色,以进行轴突再生前后的比较。如图5B和C所示,NF和NF+ES治疗组轴突再生后Tuj1和神经丝的表达水平(分别为56.3±13.0%、80.2±8.7%)增加。
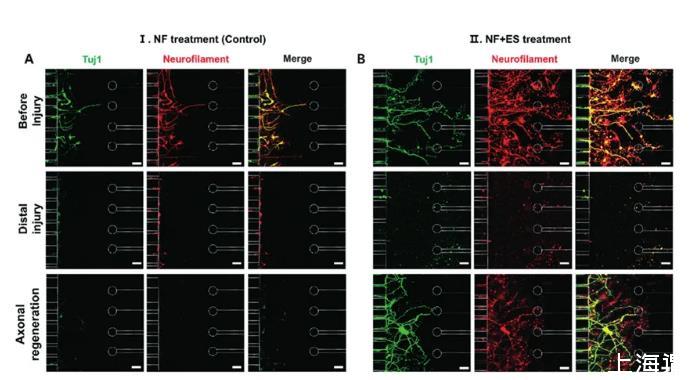
图4微流控阵列电极平台中轴突损伤与再生。
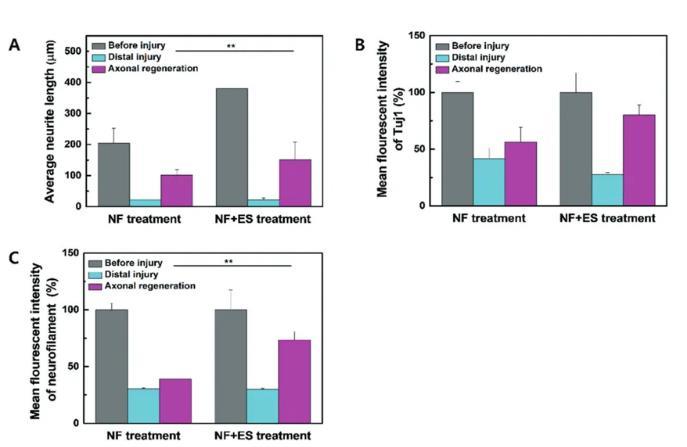
图5微流控阵列电极芯片中平均神经突长度分析。
总结
在这项研究中,微系统比传统培养系统具有更灵敏地检测治疗效果,同时能够定量检测NSC分化和轴突生长/再生。ES和NF的共刺激可以协同促进轴突伸长和NSC进一步分化为神经细胞。此外,NF和ES共刺激组比其他单一治疗组或未治疗组更能有效地抑制NSCs向星形细胞的分化。尽管需要进一步的研究来更好地了解基于细胞的研究的潜在益处和局限性,但我们的微电极芯片为药物筛选提供了强大的NSC培养平台,通过处理NF和ES治疗来促进神经分化和轴突再生。
Comments
1.这项研究提供了阵列电极更多应用,为再生医学提供了未来潜在的应用。
2.在电化学应用中电压较小,不需要考虑电极绝缘避免缓冲液电解的问题,但长时间使用仍然会污染电极。
3.这项研究的前处理过程过于繁琐。
 相关新闻
相关新闻