热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
摘要:人工湿地是一种能有效处理水体氮素污染的生态技术,其中微生物是驱动人工湿地系统中氮素去除的重要引擎。近20年来,随着分子生物学技术的广泛应用,有关人工湿地氮去除功能微生物生态学方面研究取得了一些重要进展。以硝化-反硝化作用和厌氧氨氧化作用这两种重要的人工湿地微生物脱氮途径为主,针对氨氧化细菌/古菌、厌氧氨氧化菌和反硝化菌等关键脱氮功能微生物的研究,重点归纳总结了目前有关这几类关键功能菌群在人工湿地中的丰度、活性、多样性、分布特征与影响因素,及其对废水中氮去除的作用,并在此基础上对今后的重点研究工作提出了展望。面向未来人工湿地氮去除关键功能微生物的研究应侧重其在污水净化和温室气体减排等方面的生态功能研究,同时加强其代谢过程与机制以及不同功能菌群间的关联研究。
随着社会经济和农业生产的发展,大量外源氮素进入自然水体中造成了严重的河流湖泊等水环境富营养化问题。当前,人工湿地已成为有效削减水体中外源氮素的重要技术手段,在处理非点源污染带来的氮负荷更是如此。人工湿地是由基质(原位土壤或人工填料)、生长在其上的水生植物和附着与悬浮在二者上的微生物所组成的生态系统。根据污水在系统中流动方式的差异,人工湿地污水处理系统通常可分为表面流(surface flow constructed wetlands,SFCW)和潜流(subsurface flow constructed wetlands,SSFCW)两种类型,后者又分为水平流(horizontal subsurface flow constructed wetlands,HSSFCW)和垂直流(vertical subsurface flow constructed wetlands,VSSFCW)两种进水方式;与传统污水处理工艺相比,人工湿地具有氮去除效果好、耐冲击负荷能力强、运行管理费用低和生态环境友好等优点[1]。
人工湿地系统可通过物理(沉积和挥发)、化学(基质吸附)和生物(植物吸收与微生物作用)等多种途径的协同作用去除水体中的氮素[2]。其中,微生物的作用被证实是人工湿地氮去除的主要机制,可占总去除氮量的60%—90%[3,4]。一直以来,硝化-反硝化作用被认为是人工湿地中唯一的微生物脱氮途径。硝化作用(Nitrification)是指首先由氨氧化菌将氨氮氧化成亚硝态氮,然后再被硝化菌氧化成硝态氮的过程(NH4+→NO2-→NO3-);反硝化作用(Denitrification)是指反硝化菌通过多步反应将硝态氮最终还原为氮气的过程(NO3-→NO2-→NO→N2O→N2)。直到20世纪90年代,厌氧氨氧化菌的发现打破了这一传统观念,它驱动的厌氧氨氧化过程作为一种新的微生物脱氮途径在人工湿地氮去除研究中正受到越来越多的关注。厌氧氨氧化作用(Anammox)是指在厌氧条件下,厌氧氨氧化菌以亚硝酸根作为电子受体,直接将氨氮转化为氮气的过程(NH4++NO2-→N2+2H2O)(图1)。这些具有氮转化功能的微生物是人工湿地氮去除的主要执行者,其种群结构及活性直接影响系统净化能力。早期人工湿地处理系统犹如“黑箱”一样,关于系统中功能微生物的存在及作用只能依靠间接方法如进出水的水质来推断。当前,许多科学家致力于不同类型人工湿地系统中脱氮功能微生物的研究,以此深入揭示人工湿地氮去除机制。尤其是近20年来,随着免培养的分子生态学技术包括荧光定量PCR技术(q-PCR)、原位荧光杂交技术(FISH)和克隆测序技术等的发展与应用[5],在人工湿地功能微生物丰度、群落结构组成及其时空分布等方面取得了重要进展,极大地提高了人们对人工湿地中氮去除微生物多样性的认识。然而,也存在对功能微生物在污水净化和温室气体减排等方面的生态功能研究相对匮乏的问题,功能菌群结构与氮去除效应之间的关联缺乏计量模型。当前各种新颖的分子生物学手段和分析方法层出不穷,人工湿地又是一种极其动态和多变的系统,仍有必要考虑在多尺度下或更高分辨率的取样策略下进一步加深对人工湿地中氮去除相关功能微生物多样性的研究。因此,本文通过对驱动人工湿地氮去除的几类关键功能微生物的研究方法、群落结构组成及其环境影响因素等方面的研究进展的归纳总结,进而指出当前研究的不足并展望今后研究的重点和方向,有助于更好地完善和发展人工湿地技术。
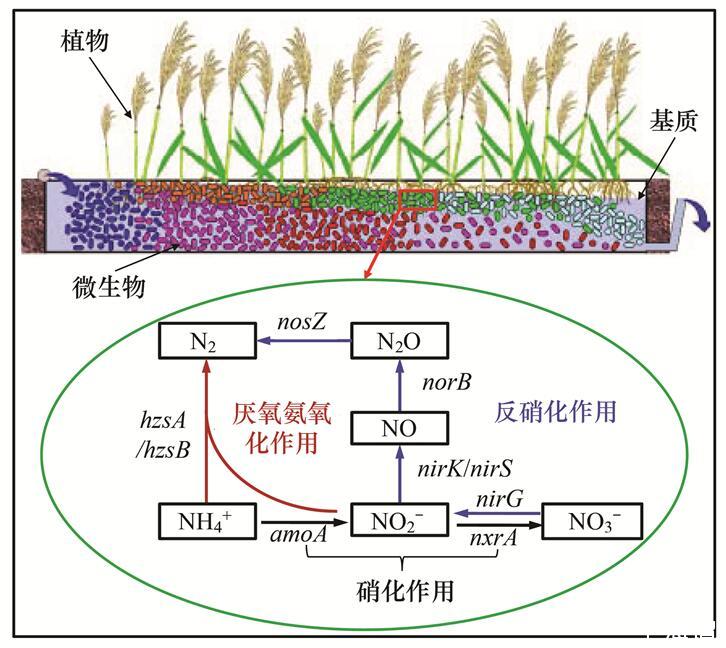
图1人工湿地氮去除关键微生物过程及相应功能基因
1、氨氧化细菌或古菌(AOB/AOA)
氨氧化是硝化作用的第一个反应步骤,也是限速步骤,是人工湿地氮去除过程的重要环节。典型的氨氧化过程通常认为是一个主要由变形菌门(Proteobacteria)中的一小部分细菌类群所进行的专性好氧的化能自养过程,这类细菌被称为氨氧化细菌(AOB)。然而近年来越来越多的证据显示,在自然界原核生物组成中占重要比例的中温泉古菌(non-thermophilic Crenarchaeota)(后单独划分为奇古菌门(Thaumarchaeota))也具有氨氧化能力,这类古菌被称作氨氧化古菌(AOA)[6]。这两类具有氨氧化作用的微生物普遍存在于海洋沉积物、湖泊底泥和陆地土壤等不同的生境中。在典型的微生物群落中,AOB所占的比例通常<0.1%,且主要集中在亚硝化球菌属(Nitrosococcus)、亚硝化单胞菌属(Nitrosomonas)和亚硝化螺菌属(Nitrosospira)这3个属[7]。相比之下,AOA无论在数量和多样性上普遍都要高于AOB,已知的主要种属有Nitrosopumilus、Nitrosophaera、Nitrosocaldus、Nitrosotalea等,但目前尚未确定是否所有的奇古菌均具有氨氧化能力[8]。
早期氨氧化菌群落的研究主要是通过富集培养及纯化分离等传统培养方式来进行。氨氧化菌特异性含有编码催化氨氧化第一步反应的氨单加氧酶基因amoA,因此研究者通常选取amoA作为分子标记基因来定性或定量研究不同环境样品中AOA/AOB的种群结构特征和丰度。而针对氨氧化菌活性的测定方法主要有底物消耗法[9]和氯酸盐抑制法[10]两种。前者是添加NH4+后通过测定培养前后NO3-或NH4+浓度的变化来计算氨氧化作用强度(以单位质量(1 kg)底泥在单位时间(h)内产生NO3-或消耗NH4+的量(mg)表示),后者是通过添加氯酸盐来抑制亚硝酸盐氧化测定培养前后NO2-量的变化来计算氨氧化速率。严格来讲,后者更能反映氨氧化菌的氮转化能力,但该方法测定值可能低于理论值(部分NO2-可能会被好氧反硝化作用消耗),因此有研究者建议最好在12 h内完成测定以减少误差[11]。
氨氧化微生物作为驱动人工湿地氮转化的一类重要功能微生物得到了研究者的广泛关注(表1)。氨氧化菌群落在人工湿地中的不同区域分布不同,植物根系是微生物最活跃的区域,根区为微生物提供了结构不同的附着表面并形成了根系分泌物和输氧浓度梯度,通常AOB数量和种类在氧含量较高的基质表层和植物根区相对较多[12]。如靖元孝等[13]研究的风车草(Cyperus alternifolius)人工湿地系统中,根区的硝化微生物数量和硝化强度远高于非根区。此外,AOB的群落结构在人工湿地系统中通常比较稳定,Roberts等[14]利用FISH技术对潜流湿地系统生物膜中氨氧化细菌Nitrosomonas的原位分析发现氨氧化菌从生物膜形成的初期就已经存在,在5个月的实验期间其占总细菌种群的比例约1%,但在提高氨氮浓度的一段时间里,Nitrosomonas很快增加到总细菌种群的7%。Ibekwe等[15]采用变性梯度凝胶技术(DGGE)研究处理奶牛场废水的人工湿地中AOB组成变化情况,发现AOB种类在系统中以Nitrosospira为主且在试验期间没有发生优势种群变化。在人工湿地系统中,AOB主要以Nitrosomonas和Nitrosospira这两种属居多,且前者比后者具有更低的基质亲和力和更高的活性,因此Nitrosospira通常发现存在于低氨氮环境中且更能忍受外界物理化学环境条件的变化,而高氨氮浓度环境下更易导致Nitrosomonas成为占主导地位的唯一优势种[16-18]。许多不同的环境因素包括温度、pH和盐度,以及氨氮和有机碳负荷等都会影响氨氧化微生物的多样性及组成。Dong等[9]对处理养猪废水的“湿地-塘-湿地”组合人工表面流湿地系统中潜在硝化速率和AOB群落进行了研究,研究发现AOB数量和硝化速率与湿地中氨氮浓度均呈显著正相关关系。Sims等[19]对一污水处理厂出水的表面流人工湿地中AOA和AOB进行了为期两年的季节性采样分析,q-PCR结果显示人工湿地底泥和水中的AOA丰度在冬夏季都普遍高于AOB,进一步采用末端限制性片段长度多态性分析(T-RFLP)发现在冬季AOB普遍具有较低的峰强,表明其对温度的敏感度要高于AOA,研究还发现人工湿地的硝化作用强度只与AOB丰度呈显著相关,表明该湿地中硝化作用主要是由AOB驱动的。人工湿地不同种类的植物以及其它微生物也会对氨氧化菌群结构造成影响。黄娟等[20]对低温域(0—15℃)下黄菖蒲、菖蒲和香蒲人工湿地系统中硝化强度和AOB/AOA数量的研究表明不同植物根际氨氧化过程的主要功能微生物具有一定差异,AOA和AOB对于湿地土壤氮转化均具有不可忽视的作用,并与植物本体、土壤硝化过程微环境之间有一定的耦合关系。Schramm等[21]研究证实氨氧化菌和异养微生物间存在竞争,随着生物膜成熟异养微生物的增加会降低氨氧化菌的种群数量。这些研究表明人工湿地系统中普遍存在氨氧化微生物,且其丰度、群落结构和代谢活性受温度、pH、溶解氧、氧化还原电位、氨氮浓度、植物等外界环境因素的影响。
表1人工湿地系统中氨氧化微生物(AOA/AOB)的国内外研究概括

2、反硝化细菌
微生物的反硝化作用是将氮素以N2O或N2形式从人工湿地中最终去除的过程。反硝化菌为兼性厌氧菌,多为化学异养型菌,在对氮转化的过程中只获得能量,并以有机物为电子供体和细胞生长碳源。具有反硝化能力的微生物种类较多,土壤中重要的反硝化细菌包括芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、微球菌(Micrococcus);水体中主要的反硝化菌有假单胞菌属(Pseudomonas)、产气单胞菌属(Aeromonas)和弧菌属(Vibrio);其它反硝化菌有气杆菌属(Aerobacter)、产碱杆菌属(Alcalogenes)、短杆菌(Brevibacterium)、黄杆菌属(Flavobactrium)等[29]。
反硝化作用的4个过程分别由硝酸还原酶(Nar)、亚硝酸还原酶(Nir)、氧化氮还原酶(Nor)和氧化亚氮还原酶(Nitrous oxide reductase,Nos)进行催化,相应编码基因分别为nar、nir、nor、nos[30]。目前针对环境样品研究者较多选择nirK/nirS和nosZ作为分子标记基因来研究反硝化菌群落多样性和丰度情况。反硝化菌活性的测定普遍采取的是乙炔抑制法[31-32]。该方法利用乙炔能够抑制N2O还原成N2的原理,向采得的样品柱通入一定量乙炔气,培养一段时间后,从中抽取一定量气体,用气相色谱分析N2O的浓度,据此计算反硝化速率。
对人工湿地系统中反硝化菌群落的研究普遍发现具有较高的丰度和多样性。Ruiz-Rueda等[33]在处理市政废水的表面流湿地中发现存在丰富的反硝化功能基因nirS。Chon等[34]采用定量PCR技术检测处理污水处理厂出水的人工湿地中反硝化功能基因(narG、nirS和nosZ)丰度都在106—109 copies/g间,并呈现季节性差异。Kjellin等[35]通过DGGE研究nosZ功能基因多样性发现越靠近人工湿地进水口反硝化菌群落越简单,且延长水力停留时间会导致表面流湿地底泥中反硝化菌的群落结构更复杂,说明底泥中碳氮浓度会对反硝化菌群具有重要影响,浓度越高菌群结构越简单优势种更明显。Song等[32]认为要使湿地中具有最大的反硝化速率必须兼有最佳的环境条件和代谢活性,该研究利用T-RFLP技术监测了一个新建人工湿地中反硝化群落的年际变化情况,结果发现第二年湿地中反硝化菌的群落结构更简单且稳定,活性也比第一年强,相关分析表明反硝化作用主要受湿地环境中温度,pH和有机碳(DOC)浓度的影响很大。一般来说氧的存在会抑制反硝化酶,但有的人工湿地中存在能够在有氧条件下进行反硝化的微生物[11],这种好氧反硝化菌含有不受氧气抑制的周质硝酸盐还原酶(Nap)。温度变化对反硝化菌有强烈影响,在温度低于5℃时反硝化速度很慢,并且在温度低进行的反硝化通常不彻底会产生N2O和NO。通常增加人工湿地中DOC含量会提高反硝化速率,但Burchell等[36]研究表明冬季低温(7.5℃)情况下反硝化速率对增加有机质并没有响应。反硝化的最佳pH值为6—8,低于5时反硝化菌的活性受到很大抑制。植物对人工湿地反硝化菌群的影响主要是通过根际分泌有机碳,许多研究证实有植物比无植物情况下对NO3-N的去除效率更高,且反硝化功能基因、速率大小会因植物种类不同而不同[33,37-39]。
3、厌氧氨氧化细菌
厌氧氨氧化作用是1995年荷兰科学家Mulder等[40]从一中试污水反硝化流化床中最早发现的。在该流化床中,一类高度富集并占主导地位的罕见自养微生物以NH4+作为电子供体直接将NO2-转化为N2,这类微生物被命名为厌氧氨氧化菌。自生物脱氮反应器中发现之后,厌氧氨氧化菌在自然生态系统中的首次报道是在海洋沉积物中。Thamdrup等[41]的研究表明在海洋沉积物中大约有24%—67%损失的氮是由厌氧氨氧化作用造成的,之后的实验进一步证实了海洋中的氮损失明显与厌氧氨氧化过程有关[42,43]。近年来,厌氧氨氧化菌在湖泊沉积物[44,45]、河口或滨海湿地[46-48]和稻田土壤[49,50]等陆地土壤或淡水生态系统中也都相继被研究报道。厌氧氨氧化菌是一种革兰氏阴性球状细菌,属于浮霉菌门,到目前为止已先后发现了5个属,包括Candidatus Brocadia[51]、Ca.Kuenenia[52]、Ca.Scalindua[43]、Ca.Anammoxoglobus[53]和Ca.Jettenia[54]。尽管不同的厌氧氨氧化菌的进化距离较远,但它们在生理、代谢、超微结构特征上并没有表现出明显的不同,而分布却随生境及生态位不同而表现出明显差异。例如,Ca.Scalindua常发现于盐度较高的海洋生态系统中[55-56],Ca.Brocadia和Ca.Kuenenia主要发现存在于自然土壤和淡水生态系统中,Ca.Jettenia则在生物反应器和污水处理厂中较常见[57]。
厌氧氨氧化细菌生长非常缓慢(倍增时间约为11d),自然条件下数量较少,至今仍未获得纯培养菌株。对厌氧氨氧化菌群落的研究主要是通过分子生物学手段如FISH、基于16S rRNA基因的聚类分析和定量分析等。用于分析环境中厌氧氨氧化菌的功能标记基因现也已确定,厌氧氨氧化代谢过程的关键酶为肼合酶,是由hzsA、hzsB和hzsC编码而成,目前不少研究者选取hzsA或hzsB作为功能基因来分析其在环境中的丰度和群落变化情况。针对厌氧氨氧化菌活性,目前国内外比较统一的方法是通过15N同位素标记(15N-IPT)技术来完成的。15N-IPT技术是根据反硝化过程和厌氧氨氧化过程的机理上的差异,反硝化反应由硝态氮经一系列中间反应产生N2,N2的两个氮原子均来自NO3-,而厌氧氨氧化反应由氨氮和亚硝态氮分别作为电子供体和受体产生N2,N2分子是由NH4+和NO3-各提供一个氮原子组成的。当进行15N同位素的示踪时,反硝化反应和厌氧氨氧化反应的差异会通过产生N2中29N2和30N2的组成得以体现[41,58]。
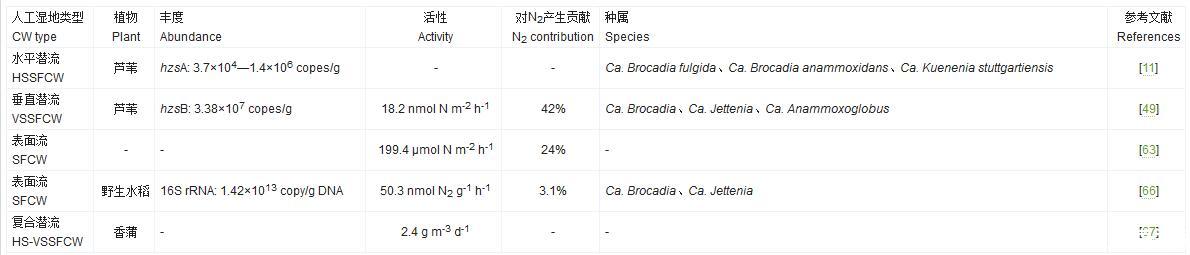
人工湿地作为一种介于生物反应器和自然湿地间的独特生态系统,有关厌氧氨氧化菌群落的研究目前还较少(表2),其群落变化和氮去除贡献并未受到足够重视[3]。Francis等[59]认为从一系列水生环境中均发现有厌氧氨氧化作用存在来看,厌氧氨氧化菌在任何含氮低氧的生态系统中都可能存在。Dong和Sun[60]利用FISH检测到垂直潜流人工湿地中存在厌氧氨氧化菌,Dong和Reddy[61]在利用PCR-DGGE技术研究养殖废水人工湿地中细菌群落时也发现有厌氧氨氧化菌属的存在,但都未做深入研究。Ligi等[62]利用基于16S rRNA基因的高通量测序技术分析了河口人工湿地沉积物中厌氧氨氧化群落结构组成,在所有测得的序列片段中属于厌氧氨氧化菌种属的比例可占至0.084%。Coban等[11]对水平潜流湿地中的氮转化微生物的研究发现,尽管利用q-PCR技术可检测到一定丰度(104—106 copes/g)的厌氧氨氧化功能基因hzsA但并未表现出活性,原因可能是湿地中存在高浓度的O2和DOC。Erler等[63]利用15N-同位素示踪技术测得表面流人工湿地土壤中最大厌氧氨氧化速率达到199.4μmol N m-2 h-1,对N2产生的贡献率为24%。这些研究证实厌氧氨氧化菌可在人工湿地系统中存在并一定条件下表现出氮转化能力,也说明适宜的环境条件对厌氧氨氧化菌的增殖和活性至关重要。在自然生态系统中,对厌氧氨氧化菌的研究或厌氧氨氧化菌的分布热区主要集中在低氧区(OMZs)[55]、土-水交界面[45]和根际圈[64]。一般来说,厌氧氨氧化菌需有足够的NH4+和NO2-作为代谢基质,也更偏好中性和厌氧环境,pH高于8.5或低于5.8、高游离氨、亚硝酸或H2S等都会抑制厌氧氨氧化菌的生长[65]。可以说,处理氮素污染水体的人工湿地系统普遍具有适合厌氧氨氧化菌生长的环境条件,如含氮、pH值中性以及易形成好氧-缺氧微区等。Waki等[66]对处理生活废水的人工湿地中厌氧氨氧化菌的分布进行了研究,结果表明厌氧氨氧化菌的丰度和活性因采样点位置、有无植物等情况导致的不同湿地环境而存在差异,其中人工湿地底泥中NO2-浓度与其活性呈正相关关系。关于人工湿地中这些外在因素如何影响厌氧氨氧化菌的详细机制还有待进一步深入探讨。
表2人工湿地系统中厌氧氨氧化菌的国内外研究概括
4、关键功能微生物对人工湿地中氮去除的效应
明确氮转化关键功能微生物的群落变化对出水水质的影响,对于指导人工湿地系统的设计和改善有着十分重要的意义。从人工湿地主要氮转化过程来看(图1),氨氧化菌驱动的亚硝化过程作为连接厌氧氨氧化和反硝化作用这两个氮去除终环节的中间桥梁,通过与不同氮转化过程的耦联作用,共同决定着人工湿地中氮的转化及最终去除。Zhi等[68]对长期运行的潮汐流人工湿地系统中氮去除与关键功能基因丰度的关联进行了定量评估,逐步回归分析发现系统对废水中NH4+的去除主要由amoA、nxrA和anammox功能基因共同控制,而NO3-的去除速率则是由nxrA和narG基因主导,该研究结果为今后在分子水平上调控或富集相关功能基因从而提高人工湿地处理效率具有积极指导作用。Li等[28,69]对绿狐尾藻湿地处理养殖废水的微宇宙实验发现系统内AOA/AOB功能基因amoA和反硝化菌功能基因nirK/nirS丰度的变化分别与水中NH4-N和NO3-N的去除具有很好的响应关系。进一步对绿狐尾藻人工湿地系统内氮素的质量平衡分析表明系统内微生物的硝化-反硝化过程对废水中总氮的去除贡献达到36.8%—62.8%[70]。厌氧氨氧化菌驱动的厌氧氨氧化过程是一种极具吸引力的微生物脱氮途径,它无需耗氧和外加碳源,也不会产生温室气体N2O,它的发现为人工湿地氮去除提供了一条新思路。Paredes等[71]的研究指出若在人工湿地中大量引入厌氧氨氧化菌生物量可增强系统对氮的去除。Zhu等[72]进一步证实了这一观点,他们发现添加硝化污泥能促进潜流湿地内氨氧化菌与厌氧氨氧化菌间的耦合作用,能显著提高湿地系统内厌氧氨氧化细菌丰度和活性,对废水氨氮和总氮的去除率也提高了11%和16%,且能够减少33%的N2O排放。N2O是一种强效温室气体其增暖效应约为CO2的298倍,并能对臭氧层造成破坏作用,因此若能丰富人工湿地处理系统中厌氧氨氧化菌群落并调控其代谢过程对于人工湿地中N2O减排将具有重要环境意义。
微生物是人工湿地氮去除能力的重要评价指标,最常见的研究方法是用微生物数量和活性作为评价污染物去除率的参考指标,探讨微生物群落的组成和分布,从而了解人工湿地处理废水时微生物在其中的作用过程。目前明确阐述关键功能微生物类群在人工湿地氮去除作用与机制的研究还较少,如某些氮转化功能微生物对温室气体的释放具有一定的调节作用,而如何应用它们控制温室气体的排放还有待深入研究。
5、展望
综上所述,现代分子生物学技术的发展为人工湿地微生物生态研究开启了新纪元,有关氮转化功能菌群在复杂的人工湿地系统中的存在、多样性组成及活性等得到了广泛研究,这对于我们深刻理解人工湿地氮去除的复杂过程具有重要推动作用。如何提高废水中氮的处理效率依然是未来人工湿地技术需解决的重要问题之一,而氮转化相关功能微生物的研究可谓重点。面向未来的人工湿地功能微生物与氮去除研究,应以新技术新方法为手段,重点开展以下几个方面的研究。
(1)进一步探索与挖掘新型氮转化功能微生物在人工湿地中的群落分布与生态功能。厌氧氨氧化菌、氨氧化古菌和一步硝化菌的发现更新了人们已有的对氮循环的认识,而新型氮转化功能种群在人工湿地系统中的研究报道还非常少,许多问题有待更多研究。例如厌氧氨氧化菌在不同类型和尺度的人工湿地系统以及不同时空变化下的普遍性和活性强度如何还不清楚,如何进一步发挥其在某些特殊废水处理中的应用潜力也需更多研究。尽管氨氧化古菌在一些人工湿地系统中能够检测到很高丰度和多样性,但大多研究表明氨氧化作用主要是由氨氧化细菌主导,对于这类含amoA基因的氨氧化古菌在系统中大量存在和分布具有的生理功能或生态学意义尚不清楚。因此,进一步采用先进分子生物学技术(如高通量测序技术等)并结合各种原位分析手段(如基于DNA分析的稳定同位素探测技术(DNA-SIP)等)明确这两类氨氧化菌群在人工湿地氮转化过程中的作用和其它潜在的生态功能是未来研究的一个重点。
(2)加强人工湿地中氮去除关键微生物的代谢过程与机制的研究。在很多情况下,相关的监测及通量(如进出水中氮浓度变化、氨挥发、N2O释放等)和反应速率(如硝化、反硝化速率、厌氧氨氧化速率等)与氮转化功能微生物的群落多样性信息并没有建立直接关联,而环境因素对其功能作用的表达又具有重要影响,因此加强对这些关键微生物的作用过程及影响因素的认识是发展调控人工湿地氮去除有效方法的重要前提。
(3)不同氮去除关键微生物菌群间的关联研究。当前研究多只针对某一类功能微生物菌群及过程独立开展,同一系统中硝化、反硝化和厌氧氨氧化等菌群间的关系以及它们各自驱动的氮转化过程是如何交替发生的尚不清楚。因此在特定人工湿地系统中研究不同氮转化功能菌群间的耦合关系,以及这种耦合关系下对废水中氮去除的贡献作用,通过关联微生物丰度和功能活性与各形态氮转化通量,构建相关氮去除模型,为最终调控人工湿地微生物过程提高氮去除率提供科学依据。
 相关新闻
相关新闻