热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
摘要
杀菌剂百菌清(CHT)因其高效、杀菌等优点在茶园中得到广泛应用。据报道,反复施用CHT会抑制土壤硝化过程。然而,CHT对土壤反硝化和相关N2O排放的急性影响尚不清楚。本研究评估了硝酸盐(NO3−)72℃高温处理后茶园土壤的去除、反硝化基因丰度和反硝化酶活性。结果发现,将CHT从5 mg kg增加到25 mg kg−1抑制NO3−去除效率从74.6%提高到54.1%,但N2O排放量从23.1%增加到94.8%。用25 mg kg治疗后−在CHT中,nirK、nirS和nosZ基因的丰度分别降低了31.6%、22.1%和50.7%。另外,电子传递系统活性(ETSA)值和三磷酸腺苷(ATP)含量的下降表明CHT对微生物代谢有抑制作用。酶活性研究进一步表明,硝酸还原酶(NAR)、亚硝酸盐还原酶(NIR)和一氧化氮还原酶(NOR)活性的降低是CHT抑制反硝化作用的主要原因。此外,反硝化还原酶活性与细胞内代谢呈正相关,表明微生物代谢的减少也应是CHT对反硝化过程的抑制作用的原因。总的来说,研究发现,土壤急性暴露于CHT可抑制反硝化过程并显著增加N2O排放,这可能导致土壤氮循环破坏和全球变暖加剧。
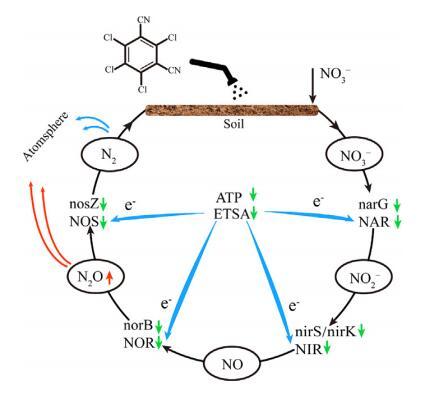
1、引言
百菌清(CHT)由于其潜在的环境毒性,近几十年来备受关注。CHT作为一种广谱非系统杀菌剂,广泛用于控制小麦、水稻、蔬菜、花生、茶叶等作物的病虫害(张等,2014)。茶叶作为许多亚洲国家的重要经济作物,需要定期施用CHT来控制茶树病害(Gilho等人,2000)。CHT能牢固粘附在茶树表面,并能抵抗雨水和水的侵蚀。作为一种中等持久性农药,CHT在不同土壤中的半衰期(t1/2s)从三天到一个月不等(Hladik和Kuivila,2008;Singh等人,2002;Van Scoy和Tjeerdema,2014;Wu等人,2012)。由于其在农业中的广泛应用,在水、沉积物和土壤中发现了CHT及其代谢产物(Hladik和Kuivila,2008;Putnam等人,2003)。
氮循环是全球生物地球化学循环的重要组成部分,与富营养化、水体酸化和温室效应等一系列环境问题密切相关。作为氮循环的关键组成部分,反硝化可以减少硝酸盐(NO3−)从陆地和水生环境到氮(N2)。特别是,脱氮过程中可能会产生一氧化二氮(N2O),这是因为其具有巨大的全球变暖潜力(比二氧化碳(CO2)高300倍)(IPCC,2006年)。先前的研究表明,CHT应用抑制了土壤微生物活性(Sigler和Turco,2002),抑制了土壤硝化过程(Kinney等人,2005),并降低了土壤氮循环的功能基因丰度(Zhang等人,2016)。例如,Kinney等人(2005)进行的一项研究表明,由于土壤硝化作用对CHT的高度敏感性,在土壤中添加CHT会减少N2O的产生。张等(2016)报道,重复施用CHT可能会对几种氮循环基因的丰度产生显着的负面影响,例如amoA、amoB和nosZ基因。此外,CHT可以在不同类型的土壤中以较高的添加速率显着抑制硝化作用(Lang和Cai,2009)。尽管之前的研究已经表明CHT对硝化有负面影响,但CHT对反硝化的影响仍不确定。
脱氮需要从NO3开始一个连续的生物还原过程−至亚硝酸盐(NO2−),一氧化氮(NO)、N2O和N2。为了完成这一过程,反硝化需要接受来自其他生物过程的电子,例如碳源代谢和电子传输系统(Zumft,1997)。电子由碳源代谢产生,并传递到电子传输系统。然后,它们将在反硝化还原过程中被消耗,该过程由硝酸还原酶(NAR)、亚硝酸盐还原酶(NIR)、一氧化氮还原酶(NOR)和氧化亚氮还原酶(NOS)催化(Saggar等人,2013)。除了电子外,碳源代谢和电子传递链也可以产生ATP。作为细胞内能量转移的货币单位,其水平与脱氮密切相关(Knowles,1980)。遗憾的是,目前尚不清楚反硝化的综合分子机制,其涵盖了广泛的方法(即ETSA值、ATP含量和反硝化酶活性)。因此,土壤反硝化过程的全貌尚不清楚。
基于此,本研究旨在探讨CHT施用对土壤反硝化的急性影响及其相关分子机制。作为试验土壤,我们收集了中国江西省的茶园土壤。本研究的具体目标是:(1)研究NO3−不同CHT暴露浓度下的减少和N2O排放;(2)研究CHT施用后的反硝化还原酶活性、反硝化基因丰度和微生物群落;(3)评估CHT对电子传递链和微生物活性的急性影响;(4)了解反硝化过程与分子生物学指标之间的相关关系。考虑到之前关于CHT应用于土壤微生物活性的报道,我们假设:1)CHT应用可以抑制土壤反硝化过程;2)CHT通过影响反硝化酶活性来抑制反硝化;3)CHT施用后其他微生物活性的相关变化会影响土壤反硝化过程;ETSA值和ATP含量与反硝化酶活性密切相关。
2、材料和方法
2.1样品和化学品
2017年7月7日,从中国江西省江西红壤研究所(28°15′N,116°55′E)采集了5公斤茶园土壤样本(0-20厘米深)。土壤在室温下风干,通过2 mm筛网筛分以去除石块和塑料碎屑,在室温下储存,然后在10小时内进行实验。实验前,部分样品用于测定CHT残留物和土壤理化性质。所有样本均未检测到CHT或其代谢物的浓度。表S1显示了采样土壤的选定物理化学性质。CHT(98%活性成分)购自中国阿拉丁科技公司。CHT标准溶液购自中国J&K Scientific。
2.2土壤急性暴露于CHT
土壤样本暴露于CHT浓度范围内(0、5、10和25 mg kg−1:分别为C0、C5、C10和C25),对应于推荐剂量(5 mg kg)−1),2倍剂量(10 mg kg−1)和5倍剂量(25 mg kg−1)(Teng等人,2017年)。简言之,将80 g干茶园土壤放置在血清瓶中,用含有相同浓度NO3的10 mL溶液处理每一种土壤−-N(110 mg kg−1)和葡萄糖(5 mg g−1).溶解CHT配方并添加到土壤样品中,以达到5、10和25 mg kg的目标浓度−1,并向一个瓶子中加入等量的蒸馏水作为对照。蒸馏水也被添加到每个瓶子中,以将最终土壤含水量保持在持水量的60%,这与土壤的原始状态相似。为了维持厌氧条件,将氮气注入蒸馏水中(30分钟,30–40毫升/分钟),以保持其最终氧化还原电位(ORP)=−300 mV和溶解氧(DO)分别为0.1 mg/L。用橡胶塞密封后,将含有土壤的血清瓶在28±1°C的恒温下培养72小时,以测定NO3−,NO2号−将相当于2 g干土的铵(NH4+)与20 mL 2 M KCL混合,并在200 rpm下摇晃30分钟(Miller等人,2008)。离心土壤溶液(4000 rpm,10分钟),并通过0.45μm孔径过滤器过滤悬浮液。然后,使用离子色谱ICS-600(美国Thermo Fisher Scientific)分析滤液。为了测定最终的N2O浓度,在培养结束时,用气密注射器抽取每个瓶子的10毫升顶空样品。使用配备电子捕获检测器的气相色谱法(2010 plus,日本岛津)分析气体样本(刘等人,2018)。根据测定的NO3−,NO2号−,土壤提取物中的NH4+和N2O浓度,NO3−,NO2号−,NH4+和N2O浓度转换为mg N kg−1土壤。如Chaves等人(2008)所述,使用气相色谱-质谱法(TQ8040,日本岛津)测定CHT残留物。支持信息中描述了细节提取和测量方法。
2.3反硝化酶活性的测定
本研究使用Zheng等人(2014b)报告的方法检测了四种反硝化酶(NAR、NIR、NOR和NOS)的活性。简言之,在72小时暴露后,使用磷酸盐缓冲盐缓冲液从5 g土壤样品中提取反硝化酶,冲洗两次,然后再悬浮在10 mL 0.1 M磷酸盐缓冲盐(PBS)溶液中,进行超声处理(4°C,200 W)和离心处理(16000 rpm,10分钟,4°C)。然后,将2 mL酶提取物添加到4 mL混合物中,该混合物根据先前报告的方法进行了修改(Zheng等人,2014b)。酶测定混合物(总体积4.0 mL)包括:100 mM PBS缓冲液、10 mM Na2S2O4和10 mM甲基紫精作为电子供体,以及2 mM电子受体(NO3)−和NO2−或NO和N2O)。培养30分钟(保持在30°C)后,NO3−和NO2−通过分光光度法测量浓度(DR 5000,HACH,美国),并通过微传感器(MMMMmeter,Unisense,Denmark)检测液相中的N2O浓度(Zheng等人,2014a)。NAR和NIR活性计算为μmol NO2-N·g−1土壤·h−1,NOR和NOS活性计算为μmol N2O-N·g−1土壤·h−1.
2.4.ETSA和ATP的测定
在本研究中,通过将2-(新苯基)-3-(对硝基苯基)-5-苯基四氮唑氯化物(INT)还原为甲赞(INF)来测量土壤中细菌的ETSA值(Broberg,1985;Wan等人,2016)。简而言之,在不同CHT浓度(C0、C5、C10和C25)下培养72小时后,在类似于酶提取过程的过程中收获细菌。然后,向收获的溶液中添加1 mL INT和1 mg烟酰胺腺嘌呤二核苷酸(NADH),并在黑暗中(30°C,30分钟,200 rpm)培养。为了终止反应,向混合物中添加1 mL甲醛。在4000 rpm下离心10分钟后,使用5 mL薄荷醇从混合物(200 rpm,20分钟)中提取INF,然后在10000 rpm下离心5分钟。最后,在490 nm处用分光光度法检测INF提取物,并根据吸光度(ABS)值计算ETSA,即μgO2·mg−1蛋白质·min−1(Wan等人,2016年)。
用磷酸氢二钠(Na2HPO4)、三氯乙酸(TCA)和百草枯(TPP)提取5 g潮湿土壤样品。提取后立即进行超声波处理(4°C,2分钟,200 W)(Martens,2001)。在离心土壤样品(4°C,20分钟,13000 rpm)后,提取悬浮液并将其储存在0°C的塑料瓶中,并使用ATP测试试剂盒(中国江苏南京建诚科技有限公司)测量ATP浓度。ATP含量也根据ABS值计算为nmol g−1.
2.5 DNA提取和实时定量PCR分析
根据制造商的说明,使用土壤快速DNA®旋转试剂盒从对照处理和C25 CHT改良处理的5 g土壤样本中提取土壤DNA。使用NanoDrop 2000紫外-可见分光光度计(美国Thermo Scientifisher)测定最终DNA浓度和纯化,并通过1%琼脂糖凝胶电泳检查DNA质量。进行实时定量PCR分析以评估细菌16S rRNA总量和反硝化过程中功能基因的丰度,包括硝酸盐还原(narG)、亚硝酸盐还原(nirK和nirS)、一氧化氮还原(norB)和氧化亚氮还原(nosZ)(表S2)(Saggar等人,2013)。所有样品一式三份。功能基因的扩增效率为85-109%,R2值为0.990-0.998。
2.6高通量16S rRNA基因测序和分析
根据标准方案对16S rRNA基因进行高通量Illumina MiSeq测序(Caporaso等人,2012年)。原始fastq文件被解复用,通过Trimmomatic进行质量过滤,并通过短读取(FLASH)软件的快速长度调整进行合并。通过核糖体数据库项目(RDP)分类器算法对照16S rRNA数据库分析每个16S rRNA基因序列的分类(http://rdp.cme.msu.edu/)使用80%的置信阈值。
2.7统计方法
所有实验参数一式三份,数据以平均值±标准差表示。使用单向方差分析(ANOVA)和Tukey t检验比较C0、C5、C10和C25处理之间的差异。使用SPSS 19.0版软件进行数据分析。统计数据在P b 0.05时被认为存在显着差异。
3、结果和讨论
3.1 CHT在土壤中的残留
如图1所示,在72小时后测量不同改良处理中的CHT残留浓度。CHT残留浓度分别为3.8±3.3、7.7±1.8和22.8±1.4 mg kg−C5、C10和C25处理中分别为1。方差分析显示,C25处理的CHT浓度在统计学上显着高于C5(P b 0.01)和C10(P b 0.01)。C10处理的CHT浓度也显着高于C5处理(P<0.05)。本研究中测得的CHT浓度高于Souza等人(2017)报告的结果,这可能是由于初始土壤应用中的浓度较高。或者,低耗散率也可能导致CHT累积。不同研究中CHT的土壤降解速率差异很大(Singh等人,2002年;Souza等人,2017年)。先前的研究表明,CHT降解与土壤条件密切相关(Van Scoy和Tjeerdema,2014),中性pH值和3-4%的总碳含量等土壤特性有利于CHT的高效降解(王等人,2011)。在本研究中,茶园土壤的低pH值可能是CHT在土壤中低效降解和高积累的原因。
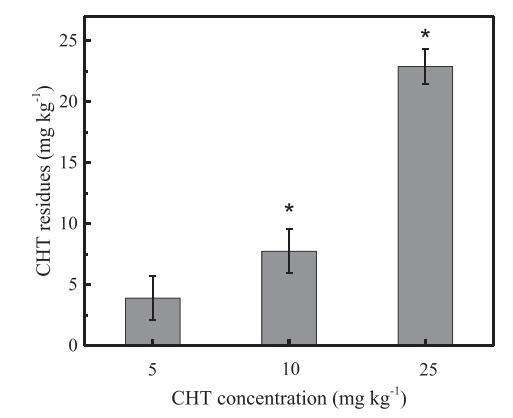
图1.三种浓度的百菌清(CHT)(5、10和25 mg kg)的残留−1)施用后72小时在土壤中。误差条表示三次测试的标准偏差。A*以上数据表明对照组和CHT处理之间存在显着差异(P b 0.05)。
3.2 CHT对土壤反硝化过程的影响
为了比较对照处理和CHT应用处理中的反硝化过程,研究了NO3的变化−和NO2−本研究确定了72小时试验期间的浓度以及最终N2O浓度。
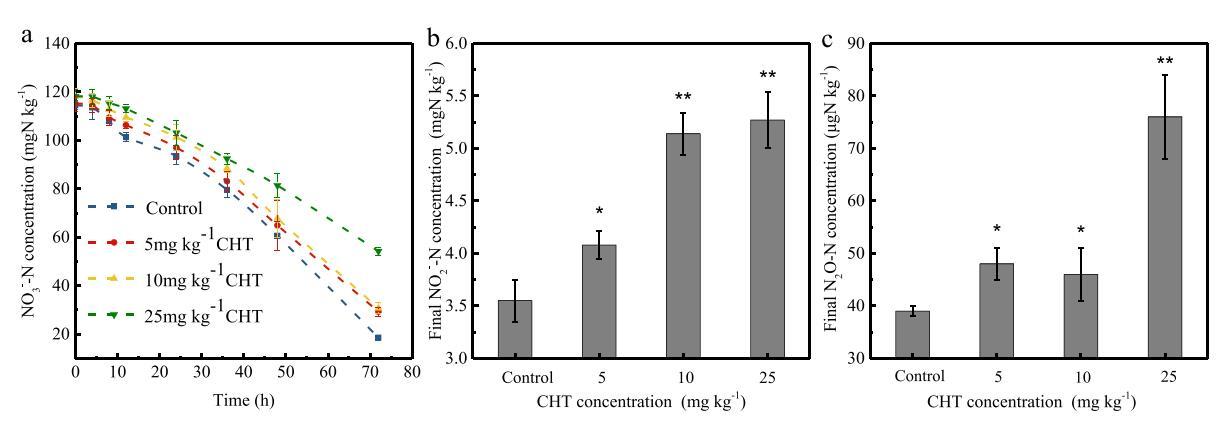
图2百菌清(CHT)对NO3变化的影响−(a),最终编号2−反硝化过程中的浓度(b)和最终N2O生成(c)。误差条表示三次测试的标准偏差。Tukey t检验,与对照组相比,*P b 0.05,**P b 0.01。
如图2a所示,NO3的最终浓度−在测试的四种处理中,范围为18.5至54.2 mg N kg−1、与C5、C10和C25处理相比,NO3的83.8%−在对照治疗(C0)中被移除。3号−C25处理的去除率显着下降至54.1%(P<0.01)。NO2的变化−72小时内的浓度如图S1所示,最终NO2−四种处理的浓度不同(C25≈C10≫C5 N C0),范围为3.5 mg N kg−1(C0)至5.3 mg N kg−1(C25)。考虑到接触CHT的潜在毒性,较高的NO2−C10(P b 0.01)和C25(P b 0.01)处理中的累积可能是由于CHT对NO3的负面影响−和NO2−还原过程。此前的一项研究也报告了不同杀菌剂(如2-氯-4-苯基苯酚和2-苄基-4-氯酚)对反硝化过程的类似抑制作用(Holzem等人,2014)。结果表明,随着杀菌剂浓度的增加,反硝化抑制作用增强。然而,郎和蔡(2009)观察到CHT和多菌灵对反硝化的不同现象。据报道,这两种杀菌剂在田间添加速率下对反硝化没有影响,而CHT在浓度为110或220 mg kg时对土壤反硝化略有抑制−1.杀菌剂对土壤反硝化作用的不同影响可能与杀菌剂类型、添加量、培养条件和土壤微生物群落有关。如图2c所示,对照组中的最终N2O浓度(39μg N kg−1)显着低于C25处理(76μg N kg)−1)(P b 0.01),比对照组高1倍。这一结果与之前的研究一致,之前的研究报告称,施用杀菌剂后,N2O排放和积累增加(Yan等人,2015年)。在本研究中,实验期间土壤NH4+浓度没有明显变化(图S2),表明没有发生实质性的硝化作用,几乎所有的N2O都是通过反硝化作用产生的。Kinney等人(2005)报告说,增加CHT施用量会抑制反硝化过程中的N2O生成。这表明CHT可能抑制NO到N2O的还原过程,并减少N2O的生成。基于这些数据,本研究中C25处理的最终N2O浓度较高可能是由于对N2O消耗过程的抑制作用强于对N2O生产过程的抑制作用。对于N2O的排放,N2O消耗过程(N2O→N2)似乎比其生产过程更重要(否→N2O)(Van den Heuvel等人,2011年)。鉴于此,本研究测定了四种反硝化酶的活性,以评估CHT对反硝化过程每个步骤的影响。
 相关新闻
相关新闻