热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
人体微生物组包含多种微生物, 共享和竞争相同的环境利基 [1, 2]。 人体内主要的微生物生长形式是 生物膜状态,其中紧密堆积的细菌、古菌和 真菌细胞必须合作和/或竞争资源 为了生存[3-6]。 我们检查了由肠道微生物组的主要真菌物种组成的混合生物膜, 白色念珠菌,以及五种常见的胃肠道细菌:脆弱拟杆菌、梭状芽孢杆菌 产气荚膜杆菌、大肠杆菌、肺炎克雷伯菌和 粪肠球菌 [7-10]。 我们观察到生物膜 由白色念珠菌形成,提供低氧微环境 支持两种厌氧菌的生长,甚至 当在通常的环境有氧条件下培养时 对细菌有毒。 我们还发现,与生物膜中的细菌共培养会诱导生物膜中的大量基因表达变化。 白色念珠菌,包括 WOR1 的上调,其编码 控制表型转换的转录调节因子 C. albicans,从“白色”细胞类型到“不透明”细胞 类型。 最后,我们观察到在悬浮培养中, 产气荚膜梭菌诱导白色念珠菌聚集成 “微型生物膜”,允许产气荚膜梭菌细胞存活 在通常有毒的环境中。 这项工作表明细菌和白色念珠菌的相互作用以多种方式调节其环境的局部化学以创造生态位 有利于它们的生长和生存。
真菌物种白色念珠菌形成混合生物膜 五种细菌
白色念珠菌,有或没有产气荚膜梭菌, 脆弱类杆菌、粪肠球菌、大肠杆菌、 或肺炎克雷伯菌细胞,粘附在牛血清包被的聚苯乙烯孔上 90 分钟,并允许 形成生物膜 24 小时,这是生产白色念珠菌生物膜的标准程序 [11, 12]。 共焦扫描激光 显微镜 (CSLM) 图像证实,在所有情况下, 真菌和细菌物种并入生物膜(图 1)。 细菌附着在白色念珠菌菌丝和 酵母形式的细胞(图 1;图 S1A-S1F 可在线获取)。 而 B. fragilis 和 C. perfringens 对 生物膜结构,大肠杆菌、粪肠球菌的掺入, 肺炎克雷伯菌降低了整体生物膜厚度(图 S1G)。 我们设计了一个菌落形成单位 (cfu) 检测作为 存在活细菌和白色念珠菌细胞的读数和 发现细菌和白色念珠菌都被掺入 随着时间的推移进入生物膜(图 2A-2D 和 S2A-S2C)。
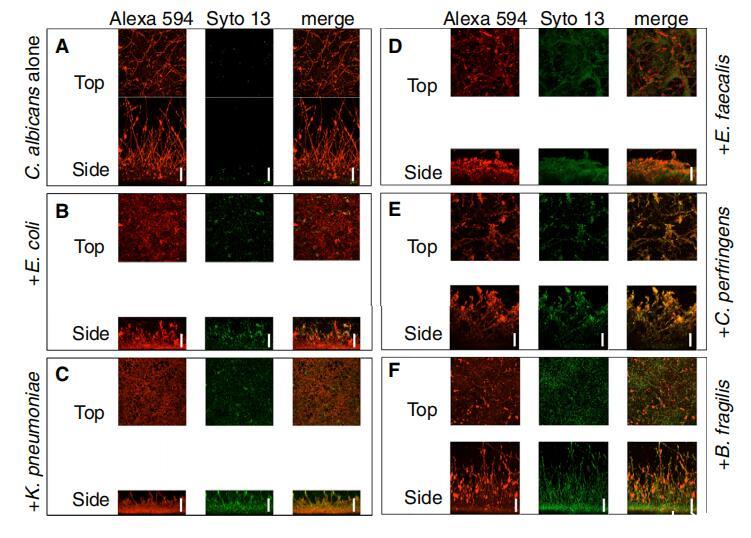
图 1. 白色念珠菌与五个形成生物膜 体外不同种类的细菌 (A-F)白色念珠菌在生物膜中生长 24 小时 单独使用 (A) 或与大肠杆菌 (B)、肺炎克雷伯菌一起使用 (C)、粪肠球菌 (D)、产气荚膜梭菌 (E) 或脆弱拟杆菌 (F)。 生物膜用伴刀豆球蛋白 A 染色, Alexa 594 和 Syto 13 染料,然后由 中海法会。 图像是最大强度投影 的顶视图和侧视图。 代表图像 至少显示三个重复。 比例尺 代表 50 毫米。 另请参见图 S1。
C. perfringes 和 B. fragilis 在共培养中增殖 在环境含氧条件下具有白色念珠菌的生物膜
白色念珠菌和/或产气荚膜梭菌或脆弱芽孢杆菌细胞在生物膜中共培养 4、24、48 或 72 小时,在环境有氧或 缺氧条件。 每个物种随时间的增长是 通过电镀测量 cfu(图 2A-2D)。 坚持 并且白色念珠菌的生长不受存在或 没有细菌细胞; 然而,最初的坚持 C. perfringens 和 B. fragilis 在存在时增加了 10 倍 白色念珠菌。 在混合生物膜中,粘附后,产气荚膜梭菌 显示出大幅增长,从 w5 3 105 cfu/ml 到 w1 3 107 cfu/ml 在 24 小时内,无论生物膜是在环境有氧还是缺氧条件下生长(图 2A 和 2C)。 没有白色念珠菌,存活的产气荚膜梭菌细胞减少 在环境含氧条件下 24 小时后低于检测值 (<10 cfu/ml)(图 2A)。 B. fragilis 表现出同样的趋势(图 2B 和 2D)。 除了标准实验室菌株 白色念珠菌 (SC5314),我们测试了另外两种临床分离株 C. albicans 并发现他们也能够支持 厌氧菌生长(图 S2D 和 S2E)。 我们的数据证明 并入生长于下的白色念珠菌生物膜 环境好氧条件使厌氧菌生长 C. perfringens 和 B. fragilis; 没有保护性生物膜, 这两种细菌物种的生存能力迅速下降。
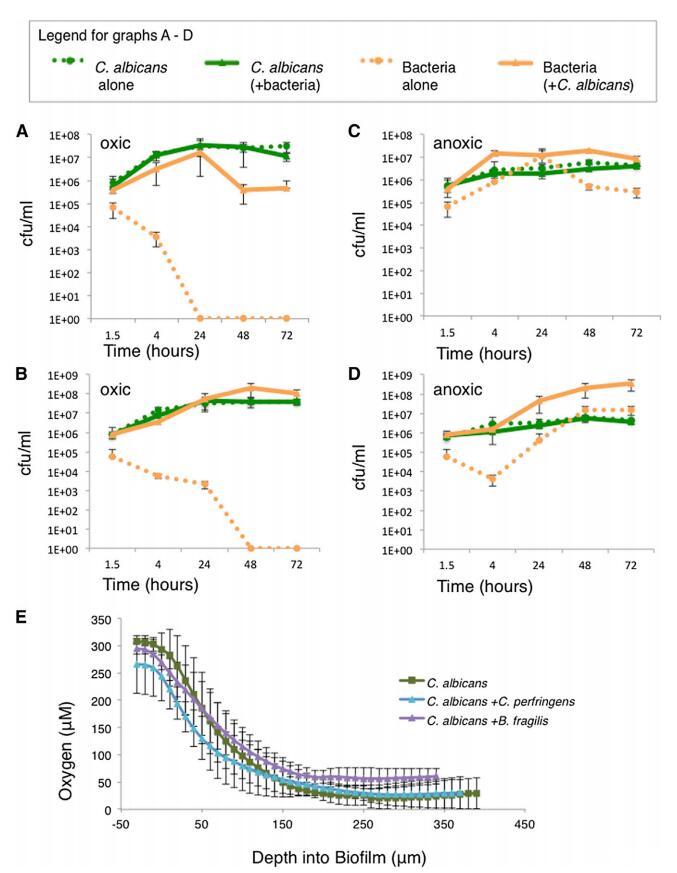
图 2. 混合物种生物膜提供了一个 厌氧菌生长的利基 (A–D) 在生物培养基中生长的指定物种的 cfu/ml 单养或共养的薄膜在好氧或 缺氧条件。 细胞是从生物 仅薄膜(不是来自生物膜上方的介质) 在 1.5、4、24、48 和 72 小时并镀上 cfu。 (A) C. albicans 和/或 C. perfringes in oxic 状况。 (B) C. albicans 和/或 B. fragilis in oxic 状况。 (C) 缺氧条件下的白色念珠菌和/或产气荚膜梭菌 状况。 (D) C. albicans 和/或 B. fragilis 在缺氧条件下。 (E) 在组成的生物膜中测量氧气 使用 STOX 传感器检测指定物种。 从顶部每 10 毫米读取一次读数 到生物膜的底部。 对于所有图形,至少两次重复的平均值 显示,误差条显示 SD。 也可以看看 图 S2。
白色念珠菌生物膜创造缺氧微环境 检验生物膜造成局部缺氧的假设 使厌氧菌生长的环境, 我们使用小型化的、 可切换的微量氧 (STOX) 传感器,一种能够 测量氧浓度低至 10 nM [13]。 使用 STOX 传感器的测量结果显示氧气梯度 整个生物膜深度的浓度,降低 从靠近生物膜顶部的 w300 mM(环境氧)到 底部附近小于 50 mM(图 2E)。 氧气 无论是否生长白色念珠菌,梯度都保持不变 在单一栽培中或与产气荚膜梭菌共培养或 B. 脆弱的。
生物膜与细菌共培养改变基因表达 在白色念珠菌中
确定白色念珠菌是否对细菌有反应 在混合物种生物膜中,我们通过微阵列测量了白色念珠菌的基因表达变化(图 3A;数据集 S1)。 相对于在不存在的情况下形成的白色念珠菌生物膜 细菌,许多基因被上调和下调 在细菌存在的情况下。 一些基因改变了表达 响应所有的细菌种类,而其他的则是 特定于少数物种。
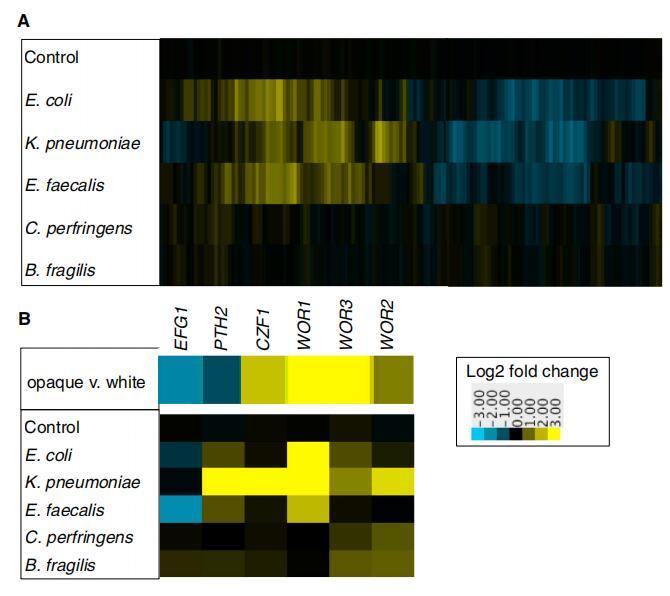
图 3. 与生物膜中的细菌共培养诱导白色念珠菌中的差异基因表达 (A) 白色念珠菌基因表达的热图 当与指定物种共培养时 生物膜,与单独的白色念珠菌相比。 显示 是至少两个生物学的中值 复制。 对照是指白色念珠菌,添加培养基以模拟细菌接种物, 与单独的白色念珠菌相比。 沿显示 x 轴是 2,863 个差异基因 在至少一种条件下调节至少 2 倍。 上调基因是黄色的; 下调 基因是蓝色的。 (B) 编码基因的基因表达模式 控制白色透明开关电路的转录调节器。 顶部面板显示 在不透明与 [14] 中的白细胞。 底部面板显示 白色念珠菌共培养时的表达水平 在具有指定细菌种类的生物膜中, 与单独的白色念珠菌相比。 另请参见图 S3。
差异最大的基因是那些 编码控制白色透明开关的转录调节因子。白色念珠菌,两个细胞之间的过渡 类型,每种类型都可以遗传多代 [15-18](图 3B)。 特别是 WOR1,它对“主”进行编码 白色不透明转换的调节器,被强烈上调 通过与肺炎克雷伯菌、大肠杆菌和粪肠球菌共培养。 与肺炎克雷伯菌共培养也诱导了几个 其他已知的转录调节因子在 白色不透明开关,以独立于 WOR1 的方式(图 S3;数据集 S2)[14, 17, 19-21]。
尽管许多不透明特异性基因被上调,但完整的不透明特异性基因表达模式是 没有观察到,当从这种情况中移除时, 白色念珠菌细胞恢复为“经典”白细胞。 我们建议 与细菌细胞共培养使 C. albicans 转变为 从白色到不透明,但需要额外的信号 用于完全切换。
C. 产气荚膜受聚集保护并诱导聚集 悬浮培养中的白色念珠菌
进一步探索白色念珠菌与 细菌微生物组成员,我们将它们在悬浮培养物中共培养,并观察到一些细菌 诱导与白色念珠菌细胞的共聚集(表 S1;图 4A-4D)。 最显着的效果发生在产气荚膜梭菌 在环境有氧条件下。 光学显微镜显示, 产气荚膜梭菌诱导的聚集体由 含有白色念珠菌和产气荚膜念珠菌的致密团块 细胞和类似微型生物膜(图 4G)。 通过监测悬浮培养中生长的产气荚膜梭菌的 cfu/ml 随着时间的推移(图 4H 和 4I),我们观察到 白色念珠菌的数量使产气荚膜梭菌在含氧悬浮液条件下存活至 w1 3 106 cfu/ml 的水平; 在没有白色念珠菌的情况下,产气荚膜念珠菌的 cfu 下降 至少五个数量级,达到检测不到的水平 (<10 cfu/ml),24 小时 (图 4H)。
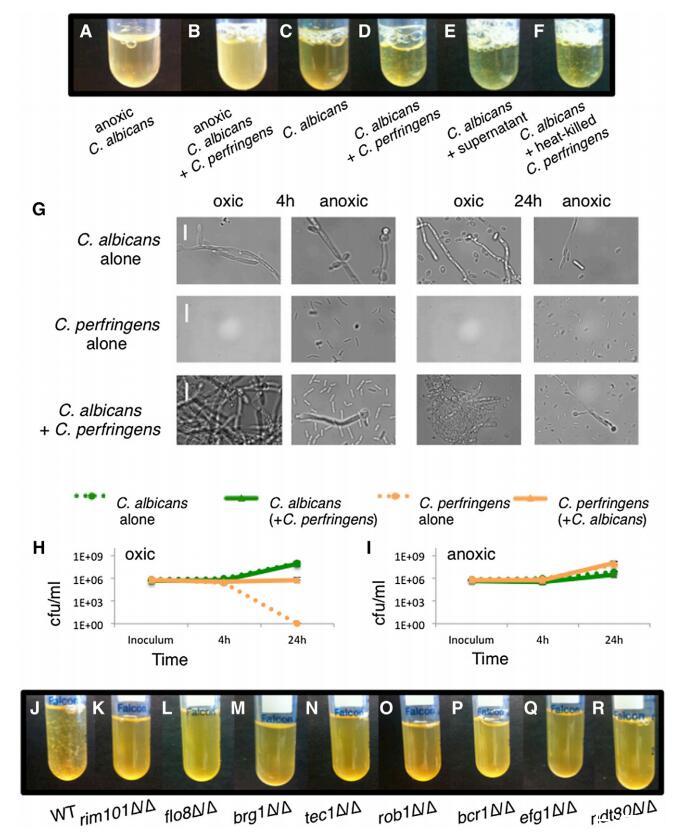
图 4. 产气荚膜梭菌诱导聚集 环境含氧、悬浮期间的白色念珠菌 共培养 白色念珠菌悬浮培养物或 不含产气荚膜梭菌,生长 4 小时或 24 小时 在 37 度,在缺氧或环境有氧条件下。 (A-F) 4 小时生长。 (A) 单独的白色念珠菌,缺氧。 (B) 白色念珠菌 + 产气荚膜念珠菌,缺氧。 (C) 单独的白色念珠菌,好氧。 (D) 白色念珠菌 + 产气荚膜梭菌,好氧。 (E) 白色念珠菌 + 无细胞上清液 C.产气荚膜培养。 (F) 白色念珠菌 + 热杀死的产气荚膜念珠菌细胞。 (G) 白色念珠菌和/或产气荚膜念珠菌的成像 光学显微镜。 代表性图像是 显示。 比例尺代表 20 毫米。 (H 和 I) cfu/ml 中生长的指定物种 单一培养或共培养,悬浮培养 在环境有氧或缺氧条件下。 (H) 环境中的白色念珠菌和/或产气荚膜念珠菌 好氧条件。 (I) 缺氧条件下的白色念珠菌和/或产气荚膜梭菌 状况。 显示的是至少两个的平均值 复制品; 误差条显示 SD。 (J–R) C. albicans 野生型或突变株 悬浮生长,在环境氧气中,对于 4 小时与产气荚膜梭菌。 (J) 重量级。 (K) rim101D/D。 (L) flo8DD/D。 (M) brg1D/D。 (N) tec1D/D。 (O) rob1D/D。 (P) bcr1D/D。 (Q) efg1D/D。 (R) ndt80D/D。 对每种条件或突变株至少进行两次测定。 另请参见图 S4。
虽然微型生物膜太 小到直接探测氧气浓度,我们注意到白色念珠菌 这些条件下的基因表达 基因显着富集 在缺氧条件下调节 (p = 1.4 3 1025 ) [22](图 S4A;数据 设置 S3),表明微型生物膜与传统的一样, 表面粘附的生物膜,提供低氧环境。 与这个想法一致,我们发现产气荚膜梭菌细胞 还刺激常规早期阶段的聚集 固体表面上的白色念珠菌生物膜形成(图 S4B)。
我们用无细胞重复悬浮生长实验 上清液或热灭活的产气荚膜梭菌细胞并观察 两者都能够诱导白色念珠菌的聚集(图 4E 和 4F)。 我们盲目筛选了205个缺失菌株的文库 在白色念珠菌中 [23](表 S2)并确定了八个转录 调节器编码基因和观察到的种间聚集所需的其他两个基因(图 4K- 4R 和 S4C)。 值得注意的是,六个转录调节因子 (Brg1、Tec1、Rob1、Bcr1、Ndt80 和 Efg1)在我们的屏幕中找到 之前确定的常规监管机构 生物膜形成 [12],提供了强有力的证据,证明产气荚膜梭菌通过生物膜遗传程序诱导聚集体形成。 其他两个缺乏聚集的调节突变体 是 rim101D/D 和 flo8D/D,尚未报告给 是常规生物膜形成所必需的。 DEF1,即 对菌丝扩展很重要 [24] 和 ALS3,它编码 一种对生物膜形成很重要并在与许多细菌物种相互作用中发挥作用的粘附素 [25-29],也是 聚合所需(图S4C)。 如补充实验程序中所述,我们量化了聚合 使用沉降测定并验证删除 菌株由基因“add-backs”补充(图 S4D 和 S4E)。
这些结果支持一个模型,即在环境好氧条件下 悬浮培养,产气荚膜梭菌诱导白色念珠菌 形成保护性聚集体,这取决于白色念珠菌 生物膜遗传程序。 这些微型生物膜,其中含有 白色念珠菌和产气荚膜梭菌,允许产气荚膜梭菌 在通常有毒的含氧条件下存活。
厌氧细菌和白色念珠菌一起生物膜内生长和在悬浮培养中诱导生物膜的形成——概括、结果