热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
研究简介:本研究通过开发一种新型的人胃上皮细胞球体与单核细胞衍生树突状细胞(MoDCs)的共培养模型,揭示了胃上皮细胞在幽门螺杆菌(Helicobacter pylori)感染下通过趋化因子依赖性机制主动募集树突状细胞(DCs)的现象。这一发现为理解胃黏膜免疫反应提供了新的视角,并为研究幽门螺杆菌感染的免疫机制提供了有力的实验工具。幽门螺杆菌是全球范围内导致慢性胃炎、消化性溃疡病和胃癌的主要病原体。胃黏膜中的树突状细胞(DCs)作为抗原递呈细胞,在启动适应性免疫反应中发挥关键作用。然而,胃黏膜中DCs如何被募集并与胃上皮细胞相互作用的机制尚不清楚。本研究通过构建胃上皮细胞球体与MoDCs的共培养模型,模拟了胃黏膜的生理环境,为研究胃上皮细胞与免疫细胞的相互作用提供了新的平台。胃上皮细胞球体通过显微注射感染幽门螺杆菌,并与MoDCs共培养。
结果显示,MoDCs能够自发迁移到胃上皮细胞的基底侧,并与上皮细胞建立紧密接触。此外幽门螺杆菌感染显著增加了DCs的募集,这一过程涉及多种趋化因子的上调,包括CXCL1、CXCL16、CXCL17和CCL20。这些趋化因子在未感染的胃上皮细胞中也有基础分泌水平,但在感染后显著上调,表明幽门螺杆菌感染通过增强上皮细胞趋化因子的分泌来促进DCs的募集。此外研究还发现,与幽门螺杆菌感染的胃上皮细胞球体共培养的MoDCs能够吞噬幽门螺杆菌,这进一步证实了胃上皮细胞与DCs之间的相互作用有助于病原体的采样和免疫监视。通过对人体胃组织样本的分析,研究人员发现幽门螺杆菌感染的胃组织中趋化因子表达增强,且DCs与上皮细胞的接触增加,这与体外共培养模型的结果一致。
本研究的创新之处在于开发了一种能够模拟胃黏膜生理环境的共培养模型,该模型不仅允许免疫细胞与胃上皮细胞的直接相互作用,还能够支持幽门螺杆菌的长期感染。这一模型为研究胃黏膜免疫反应提供了新的工具,并为理解幽门螺杆菌感染的免疫机制提供了新的视角。
Unisense微电极系统的应用
Unisense微电极应用于精确测量微小空间内的氧浓度。使用直径为25微米的OX-25克拉克型氧微电极,通过电机控制的微机械手将电极放置在胃上皮细胞球体的表面或内部,从而测量球体腔内的氧浓度分布。微电极测量的氧浓度数据表明,胃球体内部的微环境与人体胃黏膜的生理条件相似。这种低氧环境不仅支持幽门螺杆菌的生长,还可能影响胃上皮细胞的代谢和功能。通过模拟这种生理条件,研究人员能够更准确地研究幽门螺杆菌感染对胃上皮细胞的影响,以及树突状细胞(DCs)在感染中的募集和功能。
实验结果
通过构建一种新型的人胃上皮细胞球体与单核细胞衍生树突状细胞(MoDCs)的共培养模型,揭示了胃上皮细胞在幽门螺杆菌(Helicobacter pylori)感染下通过趋化因子依赖性机制主动募集树突状细胞(DCs)的现象,并阐明了其潜在的分子机制。上皮细胞能够通过分泌趋化因子主动募集树突状细胞(DCs)。在稳态条件下,未感染的胃上皮细胞球体已经能够分泌多种趋化因子(如CXCL1、CXCL8、CCL20等),并吸引MoDCs向其迁移。这表明胃上皮细胞与免疫细胞之间的相互作用是动态的,并且在没有感染的情况下也存在免疫监视机制。幽门螺杆菌感染显著增强了胃上皮细胞对DCs的募集能力。研究通过共培养实验和趋化因子分析发现,感染后胃上皮细胞分泌的趋化因子(如CXCL1、CXCL16、CXCL17、CCL20等)显著上调。这些趋化因子的上调直接促进了DCs向胃上皮细胞的迁移,从而增强了免疫细胞在感染部位的聚集。对幽门螺杆菌感染的人体胃组织样本的分析,研究发现感染部位的趋化因子表达显著增强,且DCs与胃上皮细胞的接触增加。这表明体外共培养模型的结果与体内实际情况一致,进一步验证了研究结论的可靠性。
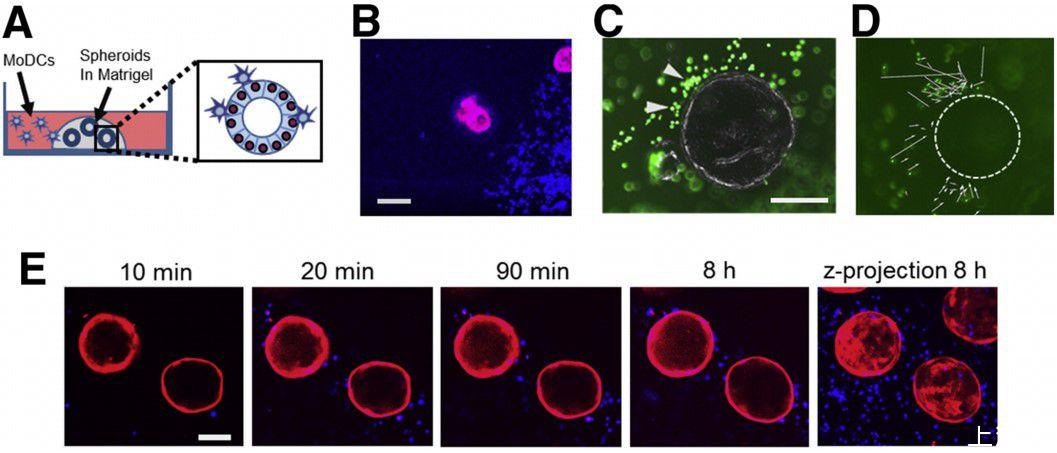
图1、MoDC与胃上皮细胞球体共培养后会自发迁移到胃上皮细胞的基外侧。(A)DC-上皮球体共培养模型的图示。(B)代表性培养板底部的荧光共聚焦图像显示了积聚细胞的Matrigel边界。蓝色,CellTracker DeepRed标记的DC;红色,表达mCherry的球形细胞。标尺:200μm。(C)具有代表性的胃球体,周围有CellTracker Green标记的MoDCs。相位对比图像与绿色荧光图像的合并。箭头表示累积的MoDCs。比例尺:200μm。(D)对延时图像的粒子追踪分析显示,DC轨迹指向球体。虚线表示球体的位置。图像由EVOS FL Auto系统以10倍物镜采集,代表4个独立实验。(E)表达mCherry的胃球体和细胞追踪DeepRed标记的MoDCs(蓝色)的延时共焦成像显示MoDCs被快速募集到球体中。共培养开始后不同时间点获得的单张图像和8小时后获得的50张切片的Z叠投影(右图,步长10μm)。
 相关新闻
相关新闻