热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
皮质内微电极(IMEs)在神经科学和脑机接口(BMI)系统中对神经信号采集至关重要,可帮助患有神经系统疾病、瘫痪和截肢的患者。然而,皮质内微电极(IMEs)往往无法长期保持稳定的信号质量,部分原因是插入过程中血管损伤引起的神经炎症。
血小板仿生纳米颗粒(PINs)具有损伤靶向功能,通过结合胶原结合肽(CBP)、冯·维勒布兰德因子结合肽(VBP)和纤维蛋白原模拟肽(FMP),模拟活性血小板的粘附和聚集。系统性给药的PINs可能增强止血作用,并促进皮质内微电极(IMEs)插入引起的血脑屏障(BBB)渗漏的重新封闭,从而减少血液源性蛋白进入脑实质引发的神经炎症。本研究探讨了PINs在减轻植入部位神经炎症方面的潜力。
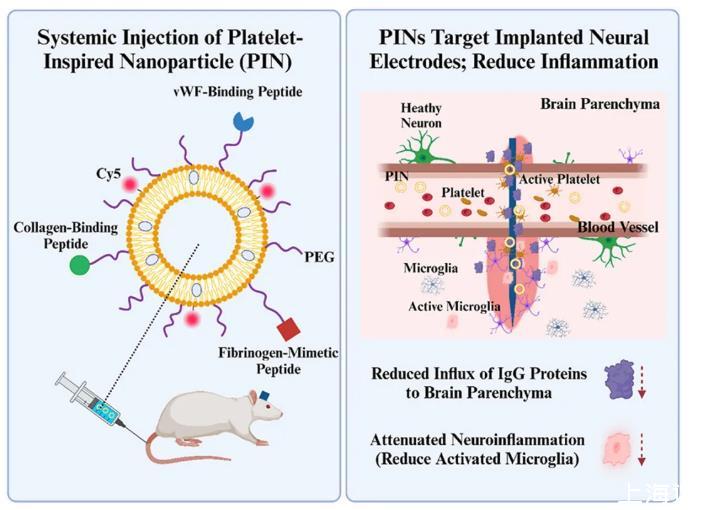
雄性Sprague Dawley大鼠接受了开颅手术和皮质内微电极(IMEs)植入,随后单次注射Cy5标记的PINs(2 mg/kg)。在植入后0至4天(DPI)的不同时间点处死大鼠,通过活体成像系统(IVIS)和免疫组织化学(IHC)分析生物分布,评估神经炎症、BBB通透性和活性血小板分布。另一组大鼠每周接受PINs、海藻糖缓冲液(TH,稀释对照)或对照纳米颗粒(CP,PEG包被的脂质体)治疗4周,并进行类似的终点分析。
结果表明,PINs在皮质内微电极(IMEs)界面附近的浓度在急性期(0-4 DPI)和重复给药4周后显著升高。在3 DPI时,活性血小板(CD62P)、活化小胶质细胞/巨噬细胞(CD68)和PINs的峰值强度被观察到。免疫球蛋白G(IgG)在植入部位附近的24小时内上调,但随后下降。在4周时,与对照组相比,PINs组表现出更高的活性血小板和PINs强度,以及更低的CD68和IgG水平。PINs有效靶向皮质内微电极(IMEs)-组织界面,并与内源性活化血小板共同作用,从而减少了神经炎症和BBB渗漏标志物。重复给药PINs为未来研究中提高神经记录质量提供了一种有前景的方法。
创新点
1.通过结合CBP、VBP和FMP,PINs模拟了血小板的损伤靶向功能,实现了对皮质内微电极(IMEs)植入部位的特异性靶向。
2.PINs通过促进BBB重新封闭和减少血液源性蛋白渗入,显著降低了皮质内微电极(IMEs)植入引起的神经炎症。
3.通过系统性给药,PINs能够有效到达皮质内微电极(IMEs)植入部位,展示了其在临床中的潜在应用价值。
4.通过4周的重复给药实验,验证了PINs在减少神经炎症和提高神经记录质量方面的长期效果。
对科研工作的启发
1.利用仿生策略设计纳米材料,模拟生物体的自然修复机制,为生物医学应用提供新思路。
2.通过结合靶向肽,开发具有高特异性的纳米药物递送系统。
3.通过减少神经炎症和BBB渗漏,提高皮质内微电极(IMEs)的长期稳定性和信号质量,推动脑机接口技术的发展。
4.结合材料科学、纳米技术和神经科学,开发新型治疗策略,解决临床中的复杂问题。
思路延伸
1.探索PINs在其他神经系统疾病中的应用潜力。
2.在PINs中同时负载抗炎药物或神经营养因子,实现多重治疗效果。
3.开展临床试验,评估PINs在人类患者中的安全性和有效性。
4.将PINs应用于其他植入设备,减少植入引起的炎症反应。
5.深入研究PINs穿透BBB的机制,优化其靶向性和治疗效果。
6.开发对炎症微环境响应的智能纳米颗粒,实现精准药物释放。
7.系统评估PINs的生物相容性和长期毒性,为其临床应用提供数据支持。
 相关新闻
相关新闻