热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
2结果
2.1相同pH值下COD/N对NO2--N和N2O的影响
图2为相同pH值下不同COD/N对NO2--N降解的影响。当COD与NO2--N之比为0(反硝化过程无外加碳源加入)时,微生物利用自身物质提供电子进行内源反硝化,NO2--N降解变化缓慢,整个反硝化过程需要240min才能完成。当加入乙醇作为碳源时,NO2--N降解速度加快,在120min之内便可完成。当COD/N为4.5时,微生物在60min之内便可完成反硝化过程。说明在反硝化过程中,NO2--N的降解速度随COD/N的增加而增大。
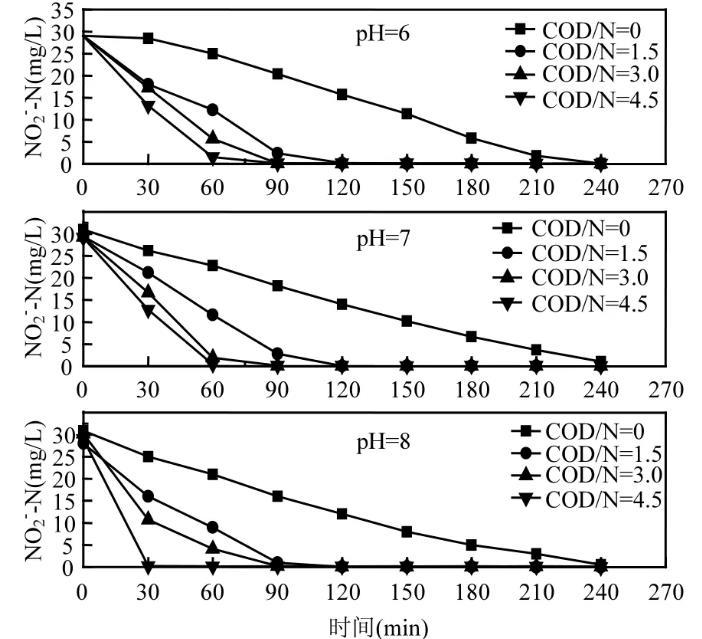
图2相同pH值不同COD/N下NO2--N的变化
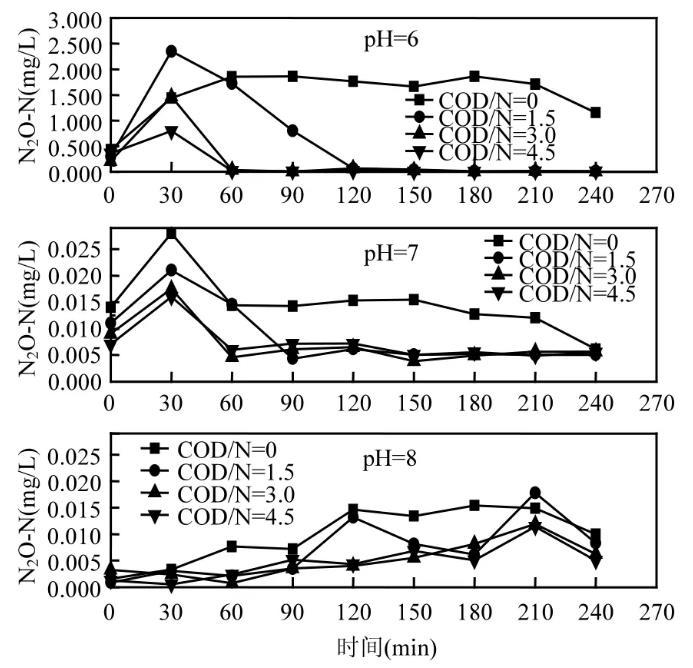
图3相同pH值不同COD/N下N2O的变化
图3为相同pH值不同COD/N下的N2O产生量变化图。由此图可知,当外加碳源为0(无外加电子供体)时,微生物靠自身内源物质进行反硝化,N2O产生量较有外加碳源时多。有外加碳源时,N2O产量很快达到峰值,然后再依次降低,COD/N为0时N2O产量先缓慢增加,再缓慢下降。在COD/N设定范围内,N2O的产生量随着COD/N的增加而减少,当COD/N分别为3和4.5时,N2O有较为相近的变化趋势,这是因为COD/N已经接近和达到使NO2--N完全还原的理论值。
2.2相同COD/N下pH值对NO2--N和N2O的影响
图4为相同COD/N不同pH值下NO2--N的变化趋势图。如图所示,在pH=8时NO2--N的降解速率明显大于pH=6、7时NO2--N的降解速率。当pH=7时,NO2--N的降解速率大于或者与pH=6的降解速率相近。这表明,在反硝化过程中NO2--N的变化同样受pH值的影响,pH=6、7时,降解速率相近,但当pH=8时,NO2--N有着相对较快的降解速率。
图5为相同COD/N不同pH值下的N2O产生变化图。其中,当pH=6时,在短程反硝化过程中N2O产生量较大,N2O产生最大值在2.4mg/L.与pH值较低时相比,pH值为7和8时的N2O产生量相近且较少,均在0.03mg/L以下。这表明,污水中较低的pH值不利于N2O的继续还原,当污水为中性或碱性时,N2O可以较快的还原为N2,不利于自身的积累。
2.3 COD/N和pH值的共同作用对NO2--N降解速率和N2O生成速率的影响
图6为不同COD/N和pH值下的NO2--N降解速率变化图。其中NO2--N的降解速率由图2中COD/N与pH值对应的NO2--N变化曲线斜率算得。由图6可见,当pH值为6、COD/N=0时,NO2--N的降解速率最低,为0.002878mgN/(mgMLSS·L·h),但是当pH=8且COD/N=4.5时,NO2--N还原速率迅速增至0.02875mgN/(mgMLSS·L·h),是pH=6、COD/N=0时的10倍。NO2--N的降解速率随着pH值的升高、碳氮比的增加而增大。
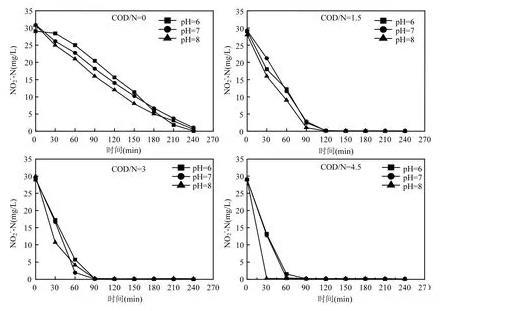
图4相同COD/N不同pH值下NO2--N的变化
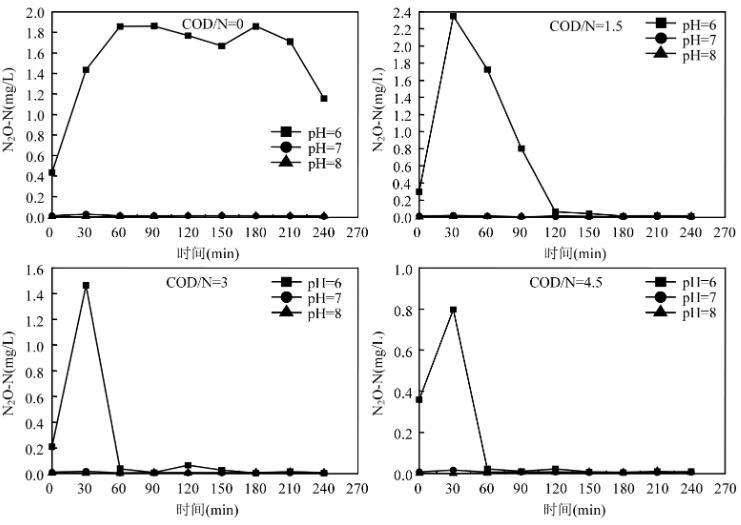
图5相同COD/N不同pH值下N2O的变化
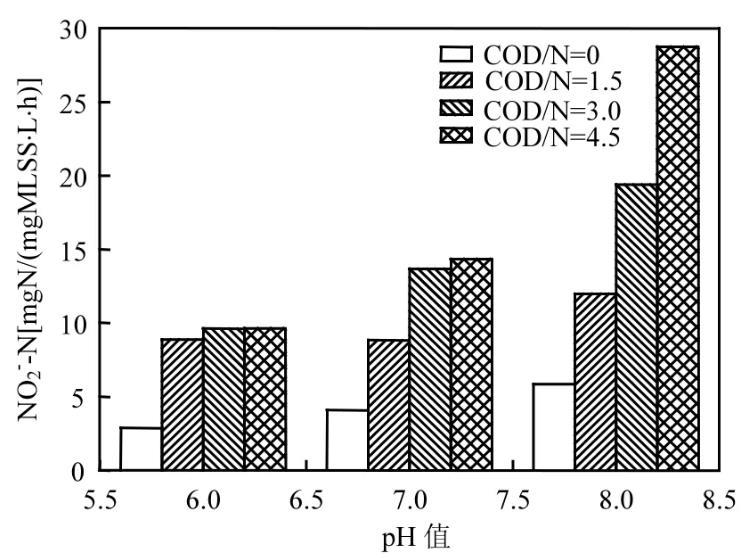
图6不同COD/N和pH值下的NO2--N降解速率变化
图7为不同COD/N和pH值下的N2O产生速率变化图。N2O变化速率由图3中的COD/N和pH值对应的N2O变化曲线增长段的斜率算得。由此图可知,当pH=7和8时,COD/N在0、1.5、3、4.5时均有较小的N2O产生速率,N2O产生速率均在2.8×10-5mgN/(mgMLSS·L·h)以下。但是,当pH值降至6,无外加碳源时,N2O的产生速率陡增至2.35×10-3mgN/(mgMLSS·L·h)。这说明,COD/N的减少和pH值的降低均对N2O产生速率产生影响,均会导致N2O较快的产生,但是N2O的产生速率随着pH值的降低变化更快,即在酸性条件下,不论碳源是否充足,N2O均有相对较大的产生速率。
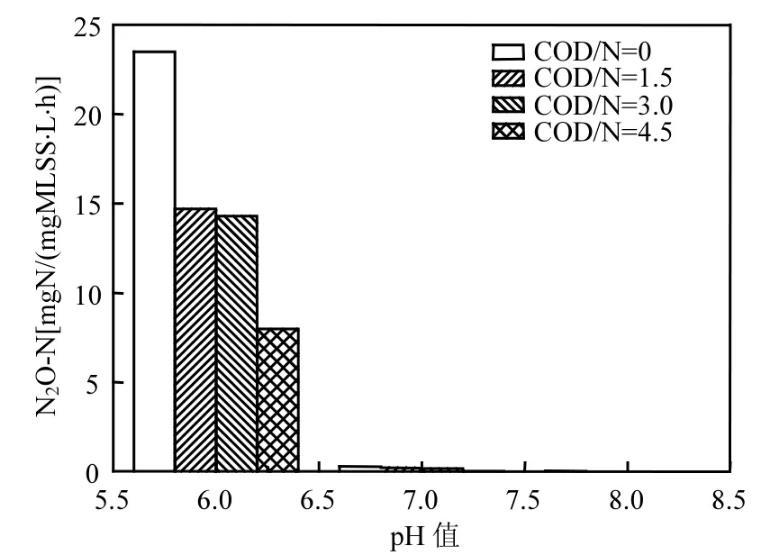
图7不同COD/N和pH值下的N2O产生速率变化
 相关新闻
相关新闻