热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
目的观察氢气吸入对重度脓毒症小鼠肠黏膜屏障功能、肠道组织氧化还原状态的影响,并探讨其机制。方法选取美国癌症研究所雄性小鼠56只,体质量20~25 g,均为5周龄,采用随机数字表法将其分为四组:假手术组(A组)、假手术+氢气组(B组)、脓毒症组(C组)和脓毒症+氢气组(D组),每组14只。采用盲肠结扎穿孔(CLP)法制备小鼠脓毒症模型。B组和D组于CLP后1、6 h吸入2%氢气1 h。CLP后24 h进行行为学评分;采集静脉血检测血中生化指标[丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、尿素氮(BUN)、肌酐(Cr)];随后处死小鼠取中段空肠,对肠道组织进行原位末端脱氧核苷酸转移酶标记法(TUNEL)染色,观察肠道组织细胞凋亡情况并评分;检测血液及肠道组织匀浆中丙二醛(MDA)水平及过氧化氢酶(CAT)、超氧化物歧化酶(SOD)的活力。结果与A组比较,C组和D组行为学评分、肠道组织凋亡指数、血生化指标(ALT、AST、BUN、Cr)水平及血清和肠道组织MDA水平升高,SOD和CAT活力降低,差异均有统计学意义(P<0.05),而B组上述指标与A组比较,差异均无统计学意义(P>0.05);与C组比较,D组行为学评分、肠道组织凋亡指数、血生化指标水平及血清和肠道组织MDA水平降低,SOD和CAT活力升高,差异均有统计学意义(P<0.05)。结论氢气吸入对重度脓毒症小鼠肠损伤和肠黏膜屏障功能破坏有明显保护作用,可能与其抗凋亡作用及对内源性氧化还原平衡状态的维持有关。
脓毒症是临床上常见的一种复杂的综合征,病理生理特征为炎症系统过度激活所导致的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)、氧化应激损伤、高凝状态、组织低灌注导致的全身组织缺氧、代偿性抗炎反应综合征及最终阶段的多器官功能障碍综合征(multiple organ dysfunction,MODS)。越来越多的研究表明,活性氧簇(reactive oxygen species,ROS)的过量产生及抗氧化防御系统功能的降低在脓毒症的发病过程中起着重要作用。因此,近来研究者们将脓毒症治疗的重点从控制失控的炎性反应转移到对ROS的清除和机体氧化还原平衡的维持方面。
肠道组织在肠腔内容物与机体之间形成2层屏障:物理/解剖屏障和免疫屏障。物理屏障是由一层互相联结在一起的上皮细胞构成,上皮细胞与固有层共同构成肠道黏膜层。肠道黏膜一方面负责肠腔内营养物质的吸收,同时把肠腔内多种有毒的物质与身体隔离开。肠道组织内这一微妙的平衡机制的破坏是多种疾病发生的基础。大量动物实验研究已经证实,肠道屏障功能破坏能造成肠腔内抗原、微生物和有害代谢产物向血循环中移位,在多种炎症性疾病的发病过程中起到重要作用,如手术后或创伤后SIRS、脓毒症和MODS。前期的研究已经证实,脓毒症中即使通过控制血流的方法改善组织氧合,肠道组织仍是极易受累的器官。
肠道功能的改变在脓毒症的发生发展中发挥着重要作用,受损的肠道组织通过促进病原微生物的侵袭及细菌毒性代谢产物的移位,在SIRS的发生中起着重要的推动作用,从而产生了一种新的理论——肠道是脓毒症发病的动力器官。因此,脓毒症患者肠道功能的改变受到特别重视,而肠黏膜屏障功能失调是脓毒症患者最常见的肠道并发症。肠黏膜屏障功能失调可以促进肠道菌群的异常增殖和细菌异位,导致二重感染和MODS的发生。肠黏膜屏障功能失调的机制可能包括脓毒症全身炎症细胞的异常激活与促炎性细胞因子的大量释放,氧自由基的大量产生造成氧化应激状态,这也是造成脓毒症患者MODS、脓毒性休克甚至死亡的重要原因。因此,针对肠黏膜屏障功能失调的有效治疗措施有可能为临床脓毒症患者的治疗带来新的希望。
本研究拟利用盲肠结扎穿孔(CLP)法诱导的小鼠重度脓毒症模型,通过全身各主要脏器生化指标[丙二醛(MDA)水平及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活力]的测定证实脓毒症全身损伤的存在,在此基础上给予2%氢气吸入治疗,以明确氢气的抗氧化特性及对机体内源性抗氧化系统功能的影响在模型中发挥的治疗作用。并重点观察给予氢气治疗后重度脓毒症小鼠模型中肠道组织的病理变化和细胞凋亡情况,并进一步探讨其可能的机制。
Unisense氢气电极的应用
使用氢微电极(Unisense)原位测量重度脓毒症小鼠肠道中的H2浓度来确定体内氢捕获情况。重度脓毒症小鼠静脉注射10 mg/kg Pd颗粒,12 h后,吸入4%氢气3 h。吸入氢气后,通过腹膜内注射7 mL/kg 20%氨基甲酸乙酯立即麻醉小鼠。腹部正中切口暴露肠道,Clark型氢气微电极插入肠道1mm,检测局部H2。实时集中麻醉和微电极稳定的整个过程仅用了3分钟,并且在个体之间是一致的。仅使用不注入Pd的氢气吸入作为对照,以区分肠道中Pd纳米粒子的局部氢捕获能力。
讨论
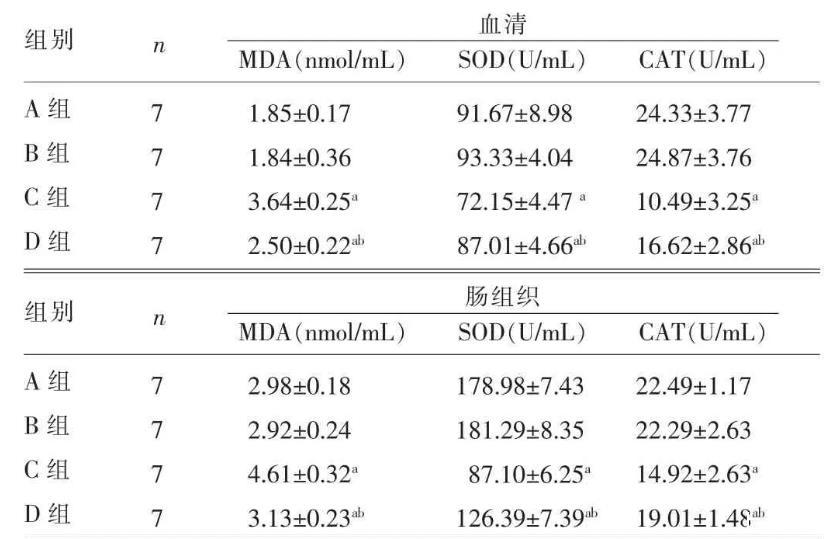
本研究通过CLP法制备小鼠脓毒症模型观察氢气吸入对重度脓毒症小鼠肠黏膜屏障功能、肠道组织氧化还原状态的影响,结果显示,CLP后小鼠行为学评分降低,生化指标出现异常,表明脓毒症模型制备成功;CLP后肠道组织凋亡指数升高,提示脓毒症诱发肠道损伤模型制备成功。
本课题组前期研究表明,CLP后1、6 h吸入2%氢气1 h可提高脓毒症小鼠生存率,故本研究选择CLP后1、6 h吸入2%氢气1 h。结果表明,吸入氢气后,脓毒症小鼠行为学评分和相关血生化指标降低,肠道凋亡指数降低,表明氢气减轻了小鼠脓毒症诱发的肠黏膜损伤。
有研究已经证明,在脓毒症的发展过程中,肠道是极易受累的器官。受损的肠道组织通过促进肠腔内抗原、微生物和有害代谢产物向血循环中移位,在SIRS的发生中起着重要的推动作用进而产生了一种新的观点——肠道是脓毒症病程进展的动力器官。因此,脓毒症患者肠道功能的改变受到越来越多的重视,而肠黏膜屏障功能受损是脓毒症患者最常见的肠道并发症。肠黏膜屏障功能失调可以促进肠道菌群的异常增殖和细菌异位,导致二重感染和MODS的发生。Doig等在危重症患者中开展的一项前瞻性队列研究证实,肠黏膜屏障功能缺陷与重症患者MODS的发生及预后存在显著相关性。肠黏膜屏障功能损伤的机制可能包括脓毒症患者全身炎症细胞的异常激活与促炎性细胞因子的大量释放,氧自由基的大量产生可造成氧化应激状态,这也是造成脓毒症患者MODS、脓毒性休克甚至死亡的重要原因。
生理情况下,由于线粒体电子逸出或还原型辅酶Ⅱ、黄嘌呤氧化酶等氧化酶的作用,机体内不断产生具有生理活性的ROS,如超氧离子、过氧化氢等,在机体内发挥重要的生理功能;并且能够被SOD、CAT、谷胱甘肽等抗氧化酶类及时清除。在脓毒症的众多发病机制中,氧自由基损伤扮演着重要角色。脓毒症时可激活中性粒细胞、单核/巨噬细胞等产生大量的ROS。有害的ROS大量堆积,通过多种途径对机体造成损伤,直接导致生物膜损伤和各种功能障碍,破坏细胞膜,进而加剧细胞凋亡活动,导致DNA严重损伤,使DNA链发生难以修复的断裂,最终导致细胞死亡。本实验通过测定脂质过氧化产物MDA水平来反映机体氧化应激状态,结果在脓毒症模型组肠组织中发现MDA水平明显增高,氢气吸入后这种增高趋势被抑制,说明肠道组织氧化损伤的存在,以及氢气对有害自由基的选择性清除作用。而抗氧化酶(CAT、SOD等)可以减轻氧化应激对组织、细胞及微结构造成的损伤。从本实验不难看出,与假手术组相比,重度脓毒症小鼠血清及肠组织中SOD和CAT活力显著降低。
综上所述,氢气通过对ROS的选择性清除、对细胞凋亡的抑制,以及对机体抗氧化防御系统的激活,在脓毒症肠道损伤中发挥保护作用。
 相关新闻
相关新闻