热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
为了阐明多重组合扰动因素对沉积物微界面环境的影响,以太湖梅梁湾沉积物为研究对象,采用Rhizon采样技术和微电极系统等手段,研究了扰动下微界面溶解氧渗透深度、pH、ORP、铁离子和含水率等变化规律。结果表明,藻类组(ES5)的OPD最大,达到了11.5 mm。不同扰动下对照组、摇蚊幼虫组、组合扰动组、河蚬组(或藻类)的pH剖面曲线趋势从左向右平移,而ORP剖面曲线从左往右的顺序分别是ES1、ES2、ES4、ES3、ES5组。河蚬组表层0~6 cm沉积物的平均含水率达到了61.68%,为各组最高。与组合扰动组相比,河蚬的出现降低了沉积物OPD,而藻类的出现进一步增大了沉积物OPD。同时,组合扰动下河蚬或藻类的出现进一步增大了沉积物pH。其次,组合扰动下河蚬的出现降低了沉积物ORP,而藻类的出现进一步增大沉积物ORP。除此之外,河蚬的出现还进一步增大了沉积物含水率和孔隙度,而藻类的出现对其并无显著性影响。
底泥扰动是促使内源磷迁移转换的关键因素。底泥扰动可分为两种:一是物理扰动,主要是风浪,水流,鱼类巡游,船运等物理因素造成的;二是生物扰动,主要是由底栖生物引起的。然而,在天然水体中,底泥扰动通常由多种形式构成,最常见的是物理扰动与底栖生物组成的组合扰动。目前,浅水湖泊磷迁移转化理论体系的构建主要是基于底泥表层的泥水界面。但是,由于底栖生物的存在,使得底泥内部存在另一种泥水界面,因为此类界面的形成过程、大小、氧化层厚度、形状、环境效应明显不同于底泥表层的泥水界面,采用建立在底泥表层的传统的磷迁移转化理论体系来解释内源磷的再生及迁移转化则明显不妥,由此人们开始关注底泥微界面环境的研究,但对于组合扰动对底泥微界面环境的影响研究甚少。有鉴于此,本研究以物理扰动、摇蚊幼虫、河蚬和藻类为主要研究对象,真实地模拟了太湖底泥多重扰动的实际情形,借此研究多重组合扰动对沉积物微界面环境的影响,以期为丰富浅水湖泊磷迁移转化理论体系奠定前期理论基础。
1材料与方法
1.1研究地点与采样准备
2015年4月利用大口径重力采样器(Rigo Co.直径90 mm,高500 mm)在无锡梅梁湾采样点(N31°31'30.10″,E120°10'57.1)采集表层15 cm沉积物柱样总计16根,并保留采样管上覆水水样,用橡皮塞密封采样管两端,再垂直地把采集到的柱样放入采样架中,同时采集上覆水50 L,采样运输过程中尽量保持柱样不发生扰动。采样点底泥及上覆水的各项理化性质见表1。
试验用藻类购自中科院水生生物研究所(武汉),品种为铜绿微囊藻(Microcystis aeruginosa),该品种是太湖水华爆发时的优势种群。实验用摇蚊幼虫购自花鸟市场,河蚬采集于太湖,为太湖原生河蚬。用梅梁湾采集来的底泥和上覆水驯化培养买回来的摇蚊幼虫和带回来的河蚬,使其适应实验条件,一周后用于实验。

表1采样点沉积物和上覆水的理化性质
1.2实验方法
实验用培养单元培养管构造见图1,培养管材料为有机玻璃(长20.5 cm,内径ID 8.4 cm),底部用橡胶塞密封;管壁留有安装Rhizon间隙水采样器的小孔,使用前用疏水胶带密封。
用400目金属筛将采集来的上覆水过滤,截除掉其中的浮游生物,过滤后的上覆水用作底泥柱样培养的上覆水。采集的沉积物柱样进行以下处理:把每个柱样表层10 cm的底泥切分成5层,每层2 cm,相同层的沉积物收集在同一桶中,将各桶内底泥通过60目金属筛以除去其中的底栖生物和大颗粒物,将过筛后的沉积物混匀,按原来顺序装入培养管中,并用切片将沉积物-水界面切成完全平整。然后将滤后上覆水引到底泥上部,尽可能不使表层底泥发生扰动且保持泥-水界面的平整。将制得的若干个(根据实验要求不同)底泥柱样放在培养水槽内,并向水槽内加入滤后上覆水淹没培养管,用曝气头对槽内水曝气预培养16 d,让底泥稳定。
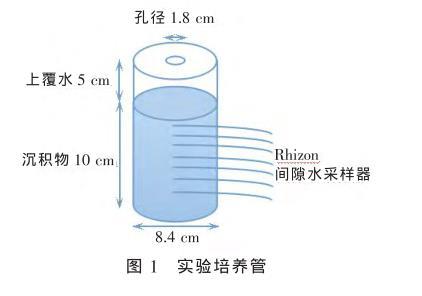
图1实验培养管
在第14天底泥已基本稳定,即泥-水界面沉降完全,泥面高度保持稳定;上覆水中的各营养盐浓度保持稳定。从培养水槽中取出沉积物柱样,将泥样柱上顶至适当位置,使得采样孔位于泥-水界面以下1.5、2.5、3.5、4.5、5.5 cm处(分别采集泥面下1~2、2~3、3~4、4~5、5~6 cm段的间隙水,采样分辨率是1 cm,由于在0.5 cm处插入的Rhizon采样管易在重力作用下将表层泥面开裂,因此原定于0.5 cm处抽取1~2 cm间隙水的小孔暂时取消),将Rhizon间隙水采样管包扎生胶带后插入培养管壁预留的小孔中以保证完全密封,插入时注意采样管的水平。将制得的培养柱样放入黑暗房间内,防止藻类光合作用对磷的影响。同时取足量预培养水放入棕色瓶中4℃保存,棕色瓶用锡箔包裹,作为实验用上覆水的补充。为了使实验结果更可靠,设置平行实验,将制得的15根柱样分别作如下实验:3根用于对照实验组(ES1)、3根用于摇蚊幼虫扰动组(ES2)、3根用于物理和摇蚊幼虫组合扰动组(ES3)、3根用于物理、摇蚊幼虫和河蚬组合扰动组(ES4)、3根用于物理、摇蚊幼虫、藻扰动组(ES5)。
在第17天,挑选活性较强的摇蚊幼虫,向组合扰动(ES2、ES3、ES4、ES5)组柱样中加入相应条数的摇蚊幼虫(密度与太湖自然密度一致),其中主要种群为羽摇蚊(Chironomus plumosus)幼虫,绝大多数的摇蚊幼虫能迅速打孔钻入底泥中,半小时过后,将尚未打孔钻入的摇蚊幼虫用镊子轻轻挑出,用新的有活力的摇蚊幼虫代替,然后将所有培养管放回黑暗房间内开启试验。以同样的的方法加入相应数量的河蚬和藻类。加入河蚬时用筷子夹住河蚬缓慢靠近泥-水界面轻轻放置于底泥表面,尽量避免产生较大扰动。
采用恒速搅拌机对柱样进行扰动,转速为150 r/min,在水面上方1 cm处扰动10 min,使得表层0.5 cm沉积物完全悬浮。试验期间,若发现摇蚊幼虫钻出泥面死亡时,立即用镊子小心挑出,并加入等量的活体。
间隙水Fe2+取样时预先在2 mL注射器针管中加入适量显色剂后抽取1 mL间隙水。采样后,立即用存于棕色瓶中的等量预培养水补充。
实验共持续了11 d(第17~27天)。间隙水在15、21、26 d采集,每次抽取2 mL间隙水。试验在第27天结束,当天用Unisense微电极分析系统测定各柱样氧剖面,随后取出Rhizon间隙水采样器,之后,将底部橡胶塞上顶,将表层10 cm沉积物切分成5层,每层底泥2 cm,将相同层位的底泥收集在同一烧杯中,用玻璃棒充分混匀。然后测定其含水率、孔隙度。
 相关新闻
相关新闻