热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
2结果
图1为烟草叶片首先受到ST的激发,5 s过后,再受到1 s的红光照射的ΔA515-550曲线,光强为1024μmol/m2·s。单周转饱和光的激发使ΔA515-550信号迅速上升,然后以双指数型在大约3 s内衰减至0。通过曲线拟合,可以得到两个指数加和形式的衰减方程为:
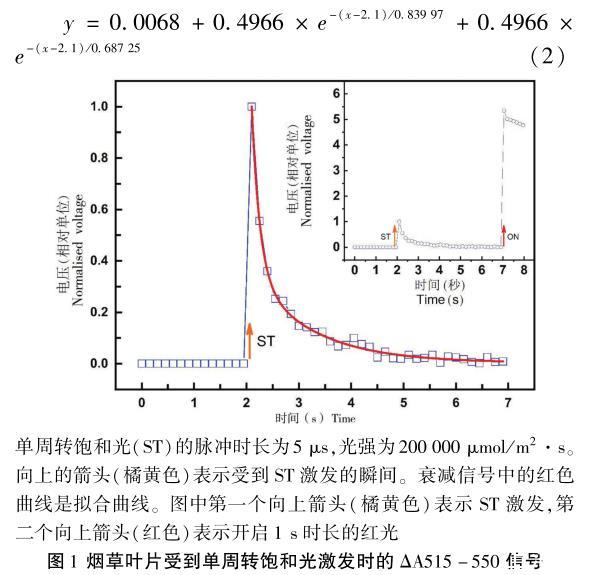
在单周转饱和光激发的条件下,ΔA515-550信号的衰减呈现明显的双指数阶段,拟合方程的第一个指数项的幂是1/0.839 97(底为e-1)要小于第二个指数项的幂1/0.687 25,因此ΔA515-550信号在第一阶段以更快的速度衰减,在第二阶段衰减的速度比第一阶段要慢。
样品首先用单周转饱和光激发,5 s后,时长为1 s的可见光开启,ΔA515-550信号可达到的最大值是受到ST激发的P515信号最大值的大约5倍。
ΔA515-550曲线在1 s可见光照射下,呈现明显的双峰特征(图2)。在可见光开启后,第一个峰值迅速形成;第二个峰值在大约100 ms出现。双峰之间产生了一个低谷。曲线最终在1 s内衰减了大约30%。这种双峰模式符合文献中记录的1 s可见光入射的测量曲线。
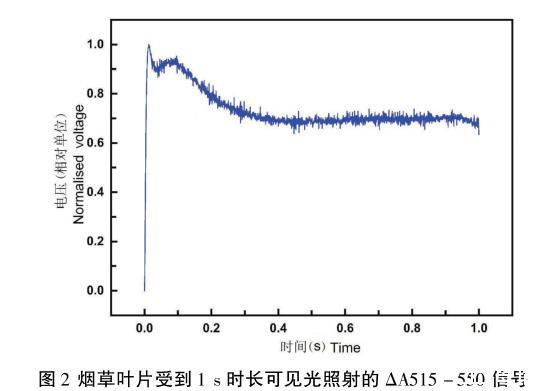
图2烟草叶片受到1 s时长可见光照射的ΔA515-550信号
图3中显示了光照60 s并在光源关闭后记录之后的120 s烟草叶片的ΔA515-550信号,此信号特征与先前Schreiber等测量的信号以及Johnson等测量的信号完全符合。此信号的特征为:光源开启后的ΔA515-550信号迅速达到峰值,随后在接下来的30 s内,信号衰减到峰值的50%左右。然后信号缓慢地提升至60 s左右达到稳态。当关闭光源时,ΔA515-550信号迅速下降至最低点,然后缓慢上升直至达到另一个稳态。
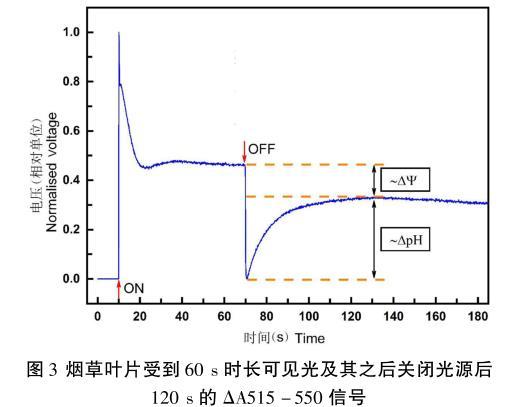
图3烟草叶片受到60 s时长可见光及其之后关闭光源后120 s的ΔA515-550信号
3讨论与结论
测量C3植物叶片的类囊体跨膜电势可以采用微电极刺入的方法,但无论是电极直接刺入法还是改进的膜片钳技术,微电极法都要求叶绿体的尺寸足够大,例如Vredenberg等在微电极法中所使用的银道椒草(Peperomiametallica)或角苔类(Anthoceros)的叶绿体,再者,微电极刺入膜内所产生的刺口处的电流流失对于跨膜电压测量也会产生不可控的损失。因此,测量电势引起的叶绿素分子的吸收峰迁移,即测量P515信号这样一种无损样本,灵敏迅捷的方法,现已成为实验室测量叶绿体跨膜电势的一种常用技术手段。
在图1中,叶片受到单周转饱和光的激发时,P515信号的快速上升反映了在光反应中心(PSI和PSII)发生的初级电荷分离反应以及后续在细胞色素b6/f发生的次级电荷转移反应。随后的电信号衰减则反映了质子的跨膜传导过程,较快的电信号衰减可能是ATP合成酶被激活而形成的质子传导所造成的,而较慢的衰减则可能是藉由类囊体膜中离子通道的质子传导所造成的。
在图2中,P515信号的双峰特征并不是必然会出现,特别是第二个峰会因为待测量的样本品种以及待测样品的生理状态不同而不同。Bulychev和Vredenberg通过同时测量样品的叶绿素荧光以及跨膜电势发现,跨膜电势的第二个峰值在时间上与荧光曲线的一个瞬时下降相关联,这可能是由下列光化学反应所造成的叶绿素荧光淬灭:质体蓝素(Pc)携带的电子传递至光化学反应中心I(PSI),并最终传递至铁氧还蛋白-NADP+-氧化还原酶(FNR)的化学反应过程。
在图3中,关闭光源后,ΔA515-550信号急剧下降至最低点,随后又缓慢地恢复上升到另一个稳态,这个稳态就被称为所谓的“黑暗基线”,根据Kramer和Scaksteder首创的“DIRK”分析,即暗黑区间弛豫分析(Dark interval relaxation kinetics)法,黑暗基线至有光时的稳态信号线的差值反映了在光照时跨膜的电势差(ΔΨ)的大小,而黑暗基线至关闭光源时,P515信号下降的最小值点的差值反映了在光照时跨膜pH值的大小。因此,对暗黑适应后的样品进行P515信号的测量,不仅可以得知关于跨膜电势的信息,也可以获知关于跨膜化学势的数据,因此,最终也可定量地获得跨膜质子动势的大小。因此,P515光谱测定方法是一种可以测量跨膜电势差、跨膜ΔpH以及跨膜质子动势差的有力武器,可为深入研究C3作物光合过程原初反应的能量转换的分子机制提供技术支持。
本研究以烟草叶片作为实验样品,使用双通道脉冲振幅可调式叶绿素荧光仪(Dual-PAM-100),并搭配最新设计的P515/535双组件模块,得出样本在单周转饱和光、1 s可见光及60 s可见光的P515光谱变化结果,并详细分析其形成原因。结果显示,P515光谱测定法是一种可以测量跨膜电势差、跨膜ΔpH以及跨膜质子动势差的灵敏迅捷、无损样本的探测技术,可为今后农业生产中的C3作物高光效品种的选育提供技术支持。
 相关新闻
相关新闻