热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
摘要:为了探究底栖动物扰动对上覆水浮游植物的影响,在实验室设沉积物~水微系统,引入广泛分布的红裸须摇蚊幼虫(Propsilocerus akamusi)和浮游植物,运用微电极等技术方法监测沉积物~水界面理化指标。结果表明,摇蚊幼虫的扰动降低了沉积物间隙水的溶解性有机磷(SRP)向上覆水的释放通量,减少了上覆水的溶解氧(DO)浓度,导致上覆水浮游植物生物量降低和群落结构向适应低磷的物种组成改变。同时,摇蚊幼虫扰动所引起的沉积物DO渗透量与沉积物~水界面SRP通量变化具有显著相关性,浮游植物生物量和上一次沉积物~水界面SRP通量变化有显著相关性,这些结果揭示了摇蚊幼虫通过改变沉积物结构和理化性质,进而能够抑制浮游植物的生长,有利于抑制水华现象的发生。
由于人们在经济生产和生活过程中忽视了自然规律。大量和农业和生活废水排人湖泊,加剧了湖泊富营养化的进程,严重危害了湖泊生态系统的健康与湖泊富营养化相伴的大面积水华的发生。致使湖泊生态系统遭到破坏。淡水资源的可持续利用受到威胁。作为水华的主角,浮游植物受到科研人员的广泛关注,科学认识浮游植物的生理特性对理解水华的发生机制有重要意义。
在湖泊生态系统中,影响浮游植物生长的因素是多方面的。在已有的研究中探讨较多的因素包括氮磷等化学因素、水温和光照等环境因子、风速等水动力学条件的影响。浮游植物作为生态系统中的一部分,生物种群相互影响和制约。针对生物因素对浮游植物群落结构和生物量的影响的研究尚属少数。一方面,不同属种的浮游植物对化学因素和物理因素变化的响应不尽相同。这与不同属种浮游植物的自身特点有关,细胞体积、表面积与体积比的差别使得浮游植物最大生长速率、沉降速率、捕食压力和速率不同;另一方面,底栖动物的生理活动能显著改变沉积物冰界面的物理和化学性质,但是有关上覆水浮游植物对这一扰动过程的响应的讨论还鲜有报道
本文通过室内培养试验模拟湖泊沉积物水界面微环境,通过构造对比试验观察浮游植物群落结构在底栖动物扰动条件下的变化,探究富营养条件下浮游植物对底栖动物扰动的响应机制。试验采用的底栖动物是在淡水湖泊中广泛分布的红裸须摇蚊幼虫(Propsilocerusakamusi)。浮游植物则采用湖泊原位野生藻。
1材料与方法
1.1野外采样与处理
本试验采样点选在富营养化程度较高的阳澄西湖(31。2714N,120。4449”E)。于2015年6月25日利用重力采样器(qb90mm——500mm)采集沉积物柱样,同时收集原位上覆水,用于后续室内培养实验。
另用彼得森采样器采集表层10am沉积物,过2mm筛,镜检挑选4龄期摇蚊幼虫,将其置于有3cm厚沉积物的玻璃缸中好氧暂养。
1.2室内培养试验设计
将所采集沉积物柱样表层20cm按2am切分成lO层,将不同沉积物柱相同层位的分层样品混匀。
过60目筛以去除其中的底栖生物和大颗粒物。最后将混匀、过筛后的各层沉积物按其原顺序装填到培养柱(l1cmx50cm)中。将所采集原位湖水用虹吸法小心引入上述培养柱中,使上覆水高度统一为20cm。将制得的1O根培养柱等量放入2个聚乙烯塑料桶中,恒温25℃预培养20d至稳定。
预培养结束后,挑选采集的4龄期摇蚊幼虫6O条均分引入到一个桶的5根培养柱中,记为摇蚊组,摇蚊幼虫投放1h后。将未钻人沉积物的摇蚊幼虫挑出,并以等量健康幼虫替换。另外一个桶中的5根培养柱不做处理,记为对照组。整个试验过程模拟自然条件,培养条件控制温度25℃。明暗交替各12h。试验期间。每天用蒸馏水及时补充蒸发损失的上覆水。
1.3样品采集与分析
试验周期引入摇蚊幼虫时记为d0,分别在d0、d7、d14、d21和d28共5个时段,分别测定摇蚊组和对照组沉积物一水界面溶解性有机磷(SRP)通量和DO浓度变化。同时采集摇蚊组和对照组上覆水样品,用于分析浮游植物变化。样品采集时,先用毛刷小心将培养柱柱壁上附着藻类刷掉,用虹吸管采集上覆水1L,加入25mL鲁哥溶液固定,避光保存。
沉积物水界面SRP通量采用上覆水中SRP浓度随时间变化的方法测定。用针筒注射器抽取沉积物一水界面上0.5em处上覆水1mL,过0.45 m醋酸纤维滤膜,用0.1mol/L盐酸酸化至pH值小于2后立即分析。上覆水采样间隔为1h。共采样5次。
为减少光合作用的影响,采样需在黑暗环境中进行。
沉积物一水界面DO浓度利用丹麦unisense微电极测定系统进行微尺度剖面分析,DO微电极尖端直径100 m,探针剖面穿刺步长200Ixm。
上覆水浮游植物鉴定采用镜检法,种类鉴定参考文献。将所采集的浮游植物样品置于1L量筒,静置48h。沉淀浓缩至30mL。充分混匀后,用移液枪准确抽取0.1mL浓缩液至载玻片,将其置于光学显微镜下(10x40)观察计数。计数方法采用行格法,保证计数细胞数在200个以上,每个样品计数2片,若2片计数差在±15%以内,取其平均值;若两次计数差在±15%以上,则计数第3片,取相近2片的平均值。
1.4数据分析与处理
沉积物冰界面SRP通量按照张雷等的方法
计算:
F=kV/A(1)
式中:F为SRP在沉积物水界面的通量,mg/(m2·h);k为SRP浓度随时间变化的线性回归率,mg/(L·h);V为上覆水体积。L;A为沉积物表面积,m 2。
浮游植物生物量参照Hillebrand等的研究成果,通过体积法计算,取几何近似值。通常,可以将浮游植物的密度近似等于水的密度。故而浮游植物的质量在数值上便与其体积一致。根据浮游植物细胞外形的不同,可以用圆球、圆柱、椭圆柱、圆台等组合起来去拟合细胞体积,这种计算生物量的方法就叫作体积法。
本文中数据结果图均采用origin8.0软件绘制。
2结果
2.1浮游植物细胞数和生物量变化
在整个培养期,对照组和摇蚊组上覆水浮游植物细胞数变化范围分别为36.71万——61.34万个/L和30.16万一54.86万个/L。对照组和摇蚊组上覆水浮游植物生物量变化范围分别为0.98mg/L——1.42mg/L和0.77mg/L——1.38mg/L。在所有统计中。浮游植物细胞数和生物量在对照组和摇蚊组有相同的变化趋势(图1、图2)。根据细胞数和生物量的变化,对照组可以划分为两个阶段:上升期d0一d7和下降期d14一d28,生物量最高出现在d7时,最低出现在d28时。摇蚊组变化则可以分为3个阶段:上升期dO—d7、下降期d14一d2l和回升期d28,生物量最高出现在d7时,最低出现在d21时。
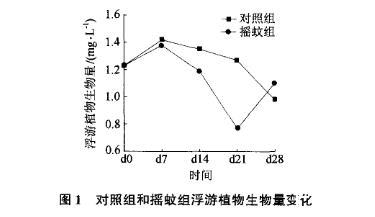
图1对照组和摇蚊组浮游植物生物量变化
2.2浮游植物种类组成的变化
所示。对照组在d7出现的种类最多,共检出6门27属47种浮游植物,组成情况详见表1;在d28出现的种类最少,共检出6门17属34种,组成情况详见表1。由图2可知,对照组在试验各阶段,各门类浮游植物占比虽有变化。但蓝藻始终占有绝对优势。
在d0和d7时蓝藻占比最高。达到了45.0%和40.9%,蓝藻占比最低时在d28,为28。l%而摇蚊组,受摇蚊扰动的影响,试验过程中各门类浮游植物占比变化较大,优势群也不断变化。在d0、d7和d28时蓝藻为优势群,在d14和d21以硅藻为优势群,而蓝藻和绿藻占比都下降明显。为将优势种控制在一定数目。本试验以藻种细胞数占本次采样所得藻细胞总数超过10%的藻种作为优势种,两组各次采样优势种变化见表1。
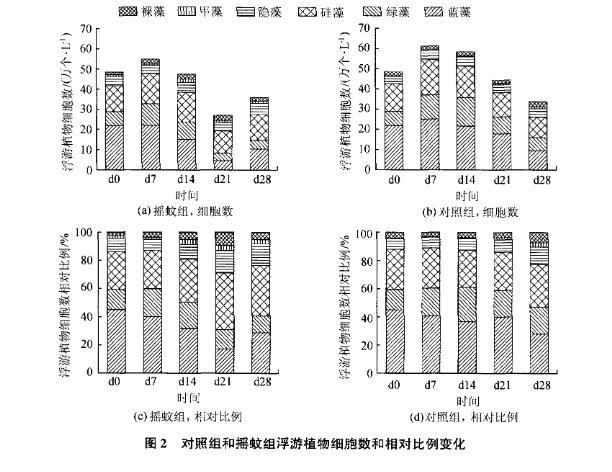
在两组浮游植物生物量下降的同时,浮游植物种类也同时减少了,说明在磷大量减少的情况下。一些藻种数量急剧下降甚至消失以至于镜检不到虽然两组培养过程中都经历了浮游植物数量的下降,但是不同藻种下降程度却相差很大。数量下降最多的是摇蚊组的蓝藻门(图2),尤其是束丝藻属,从最高2.2l万个/L下降为最低0.27万个/L。与此形成鲜明对比的是微囊藻属,下降幅度并不大,从最高3.98万个/L下降为最低3.15万个/L。两组浮游植物数量大幅下降阶段,硅藻门数量下降也不明显,这是浮游植物数量下降时硅藻占比上升的根本原
摇蚊组和对照组浮游植物种类组成变化如图2。
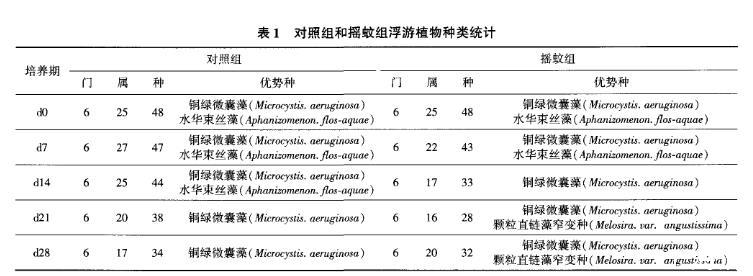
表1对照组和摇蚊组浮游植物种类统计
2.3沉积物水界面SRP通量的变化
加入摇蚊幼虫前。摇蚊组和对照组SRP在沉积物一水界面通量相近(图3)。加入摇蚊幼虫明显改变了摇蚊组SRP在沉积物一水界面的通量整个培养过程中,对照组的SRP在沉积物一水界面通量一直下降,从0.156mr,/(m·h)(dO)下降到0.035mg/(m·h)(d28)。摇蚊组在培养前中期,SRP在沉积物一水界面通量比对照组下降更为明显。从0.156mg/(in·h)(dO)下降到一0.061mg/(131·h)(d14),但在后期回升到0.067mg/(m·h)(d28)(图3)。相关性分析显示,上覆水浮游植物生物量与沉积物一水界面SRP通量相关性并不显著,但是与上一次采样的SRP通量具有显著相关性,表明SRP通量对浮游植物的影响具有滞后性(表2)。
2.4沉积物DO的变化
在投入摇蚊幼虫前,沉积物DO不存在显著差异(图4)。加入摇蚊幼虫后,明显增加了DO的渗透深度,渗透深度和范围最强的时期出现在d21,在d28这种影响又有所减弱。
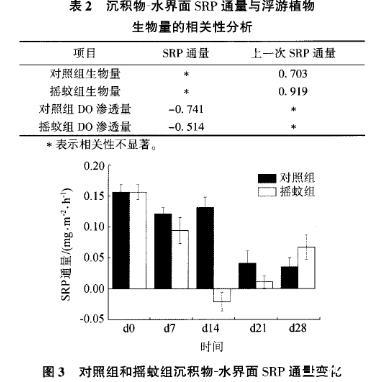
图3对照组和摇蚊组沉积物一水界面SRP通量变化
同时,试验结果还显示,上覆水DO浓度受摇蚊扰动影响也有部分下降(图4)。相关性分析显示,沉积物DO渗透量与沉积物一水界面的SRP通量具有显著负相关性,表明由于摇蚊幼虫的扰动引起的DO在沉积物中的渗透量越高,沉积物水界面的SRP通量越小(表2)。
 相关新闻
相关新闻