热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
以谷氨酸兴奋性毒性为主要特征的神经毒性损伤,与卒中的发生、发展,神经元的坏死和细胞的凋亡都存在密切的联系,卒中后的再灌注损伤成为目前亟待解决的问题。目前已证实一些神经保护剂可减少谷氨酸的释放,低温也可降低谷氨酸的释放,因此了解缺血后谷氨酸的动态变化有助于认识神经细胞坏死的程度,从而为今后延缓或阻止细胞坏死提供药物治疗的评价依据。卒中后大部分患者经受着不同程度的偏侧瘫痪或运动障碍,皮质运动区负责对侧半身的随意运动,卒中引起的对侧偏瘫表明病灶同侧的皮质运动区产生了病理改变,而皮层的损伤程度为判断预后提供了帮助。CIRSTEA等也通过磁共振波谱证实卒中6个月后病灶同侧正常显影的灰质中的谷氨酸浓度与肢体瘫痪程度呈正相关,因此谷氨酸的变化也有助于卒中后临床表现进程的研究,从而作为卒中预后指标。
如今,非人灵长类动物作为临床前研究的重要实验对象,对于灵长类动物缺血后皮层谷氨酸的动态变化尚少见报道,因此,本研究运用电化学微电极传感器技术检测活体食蟹猴脑缺血过程中皮层谷氨酸水平及动态变化,为今后进一步探索脑缺血皮层谷氨酸动态变化与卒中临床表现的关系提供依据,旨在为谷氨酸成为治疗评价及预后判断的指标奠定理论基础。
1.材料与方法
1.1研究对象
所用动物来自广西南宁灵康赛诺科生物科技有限公司实验室(以下简称灵康公司),该实验室经过国际动物评估认证管理委员会(AAALAC)认证。选取3只正常食蟹猴,编号为NHP1、NHP2、NHP3,NHP1为雄性,6岁,9.5 kg;NHP2为雌性,9岁,4.2 kg;NHP3为雌性,7岁,4.0 kg。本研究在灵康公司灵长类动物实验室进行,3只动物分别放置在标准单笼(深×宽×高为60 cm×77 cm×75 cm)内饲养,动物房温度22~28℃,相对湿度为30%~75%,12 h/12 h明暗交替,每日早晚两次喂食标准饲料(碳水化合物0.492 g/g,蛋白质0.237 g/g,脂肪0.061 g/g),中午给予1次新鲜蔬菜或水果,动物不限制进水。本研究方案已递交灵康动物伦理委员会(IACUC)审核并获得批准。
1.2方法
1.2.1主要仪器
FAST-mkⅢ神经递质实时检测系统(美国Quanteon公司),谷氨酸检测电极来自美国肯塔基大学微电极技术中心。
1.2.2缺血性脑卒中模型的建立和谷氨酸实时动态检测
实验食蟹猴术前禁食16 h,常规麻醉,舒眠宁(0.03 mL/kg)、阿托品(0.04 mg/kg)肌注,术中持续异氟烷(1%~3%)吸入麻醉。头部备皮,常规消毒铺巾。将左侧颧弓上缘水平线与眶外缘垂直线连线交点,和颅骨矢状线与双外耳道连线(颅骨映射线)交点,两交点连线即为左侧大脑中动脉大致走行方向,沿该连线做一长切口,依次进入皮肤、皮下组织、筋膜、颞肌,翻开并去掉部分颞肌,暴露颅骨,以左侧颧弓上缘上侧与眶外缘后侧为边界做一约20 mm×15 mm颅骨开窗(骨窗一);在同侧皮层运动区做一约15 mm×10 mm颅骨开窗(骨窗二)。在骨窗一,沿大脑外侧裂经脑棉保护向内游离暴露大脑中动脉(middle cerebral artery,MCA)M1段,将MCA M1近端夹闭1 h后放开。在骨窗二,将谷氨酸检测电极固定于立体定向支架上,并连接FAST-16mkⅢ神经递质实时检测系统,获取夹闭前1 h、夹闭时1 h及夹闭放开后1 h该部位谷氨酸的持续变化,这3个时间窗内谷氨酸检测为连续性的,均在1次手术中完成。检测完毕,缝合骨窗一骨瓣,骨蜡密封,保留骨窗二,关颅缝皮。在术后第1周和第2周经骨窗二进行谷氨酸实时动态检测1 h,手术准备与操作同前,谷氨酸检测方法已有应用。
1.2.3谷氨酸电化学检测
谷氨酸电化学检测主要分为校准和检测。每次实验检测前对所用电极进行检测物(谷氨酸)、干扰物(抗坏血酸)、可能影响物(如过氧化氢、多巴胺等)比对校准,获取电极检测限、灵敏度、特异性、浓度线性拟合(R2)等参数,本实验校准参数如下(n=9):检测限为(1.18±0.88)μmol/L,灵敏度为(5.3±4.4)pA/(μmol·L),谷氨酸特异性(谷氨酸氧化反应电流/抗坏血酸还原反应电流)为(9.7±5.7):1,R2为(0.993 1±0.010 0)。校准后将检测电极与FAST-16mkⅢ系统连接置于检测部位,便可用于检测。
1.2.4谷氨酸检测位点
选取手术同侧皮层运动区的脑回,检测深度位于脑表面下3 mm,选取的位点已在类似研究中应用,具体为耳棒:15.0~20.0 mm,中线:10.0~11.0 mm。该区域为大脑中动脉供血区,支配上肢运动区域。
2.结果
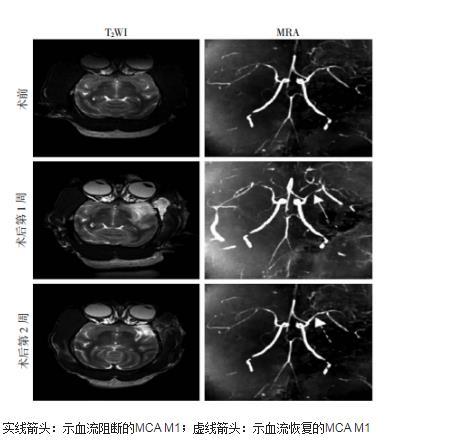
图1食蟹猴在夹闭MCA M1的术前、术后第1周和术后第2周的T2WI及MRA影像学表现
脑缺血过程中的谷氨酸变化
谷氨酸采集频率为4 Hz,每个检测窗各选取3段30 s检测浓度进行分析,每段之间相隔10~20 min,所得数据由每段检测浓度的平均值获得。皮层运动区谷氨酸浓度:3只食蟹猴术前基础浓度(7.7±6.1)μmol/L,夹闭MCA M1(37.8±25.2)μmol/L,夹闭放开(38.3±25.1)μmol/L;术后第1周(12.2±9.5)μmol/L;术后第2周(23.7±26.1)μmol/L。在夹闭MCA M1时或夹闭放开后较基础浓度升高(t=4.200,P=0.003;t=4.25,P=0.003),夹闭放开后较夹闭MCA M1时谷氨酸浓度变化差异无统计学意义(t=0.160,P=0.877),术后第1周较夹闭MCA M1时或夹闭放开后谷氨酸浓度明显下降(t=3.95,P=0.004;t=4.320,P=0.003),术后第2周较术后第1周谷氨酸浓度变化差异无统计学意义(t=1.970,P=0.085)。
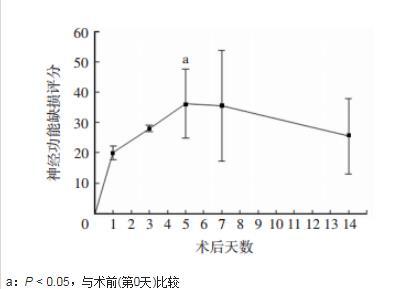
图2食蟹猴在夹闭MCA M1后2周内神经功能缺损评分的变化
3.结论
本研究使用的FAST-mkⅢ系统,检测频率为1~1 000 Hz,检测电极尖端宽度150μm。相对于微透析技术,FAST具有创伤性更小、检测频率更高、即时记录等特点,可以检测亚秒级的谷氨酸瞬时变化并即时记录,几乎不存在时间延迟效应,能够非常精确地反映脑内神经递质的瞬时变化水平。本研究中各检测窗还未发现谷氨酸浓度骤然的起伏,只是在夹闭MCA M1后出现过缓慢的持续上升过程。目前的不足之处在于,利用FAST系统进行缺血食蟹猴清醒状态下长期在体检测的技术难题仍未解决。
总而言之,本研究活体检测食蟹猴缺血过程中皮层谷氨酸的动态变化,或许能够为卒中进展过程中临床表现的变化提供评价依据,为谷氨酸成为卒中治疗和判断预后的指标提供可能。
 相关新闻
相关新闻