热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
研究简介:破骨细胞介导的骨代谢是维持骨骼系统基本生理功能的精心策划的过程。破骨细胞过度活跃是骨疾病的典型特征,包括骨质疏松、肿瘤骨转移、牙周病和类风湿性关节炎相关的关节破坏,而破骨细胞活性过低可诱发石骨症。破骨细胞分化障碍可导致骨折时骨不连、骨愈合延迟和假体松动。为了充分利用前破骨细胞的功能,人们已经探索了许多策略来阻止破骨细胞在前破骨细胞阶段的分化,其中大多数是通过全身或局部应用外源性细胞因子、肽、药物和甚至基因编辑。然而由于伦理问题和临床上未知的副作用,这些方法很难实施。研究证明,硬度增加有助于破骨细胞通过细胞骨架排列分化。然而基质硬度调节破骨细胞分化的机制仍不清楚,需要通过体内验证实验。研究人员提出调节基质刚度可能是准确调节破骨细胞分化的策略。制备了具有不同骨组织生理硬度的水凝胶,并探讨了基质硬度如何在体外和体内调节单核细胞/巨噬细胞向前破骨细胞/破骨细胞的分化。结果显示,随着水凝胶硬度从2.43 kPa(接近骨髓生态位硬度)增加到68.2 kPa(未成熟骨组织硬度),破骨细胞形成得到促进。从机械角度来看,随着基质硬度的增加,整合素β3响应的RhoA-ROCK2-YAP信号逐渐受损,从而促进NF-κB信号,从而促进破骨细胞分化。由于机械转导部分受损,破骨细胞分化在具有相似血管硬度的水凝胶上的破骨细胞前阶段停止,导致破骨细胞前触发H型血管侵袭和小鼠股骨远端缺损的骨再生。本研究工作总结了种植体硬度对破骨细胞命运的调节模式,并提出了一种调节破骨细胞的新策略。
Unisense氧气微电极系统的应用
测量氧含量以功能评估骨缺损中的血管向内生长。使用微电极系统(Unisense)来确定氧分压。用异氟烷麻醉小鼠,然后脱毛并暴露。氧传感器微电极(100μm)依次用饱和氧溶液和无氧溶液进行校准。然后将微电极小心地注入骨缺损处,由马达控制器控制微电极的深度为500μm。测量骨髓腔中的氧分压作为对照。
实验结果
提出调节基质刚度可能是调节体外和体内破骨细胞生成的有效方法。研究发现增加基质硬度通过抑制整合素介导的机械转导来促进破骨细胞生成。值得注意的是,由于机械传导部分受阻,只有具有与血管相似硬度的基质才能促进前破骨细胞分化,促进血运重建和骨再生。本研究工作为破骨细胞生成的精确调节提供了一种新策略,并使能够进一步开发基于基质刚度的骨疾病策略。
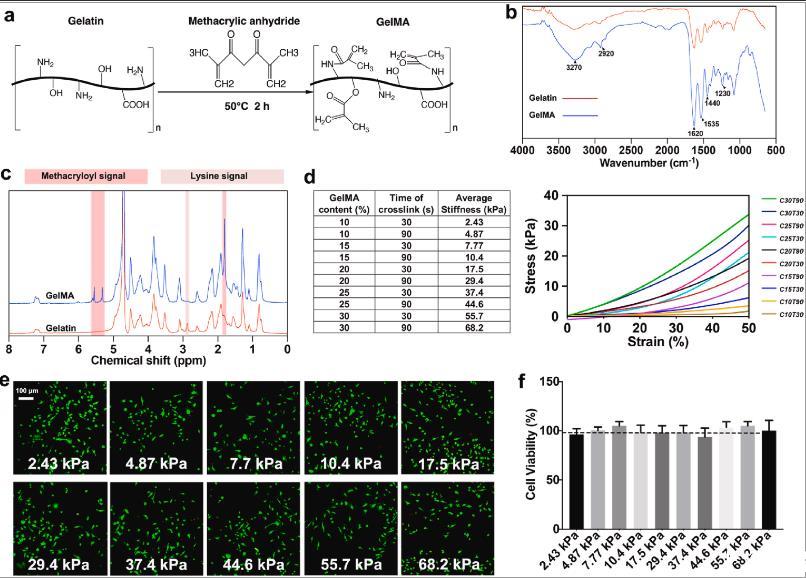
图1、具有不同硬度的GelMA水凝胶的表征。(a)紫外线交联GelMA水凝胶制备方案。(b)通过FTIR-ATR分析明胶和GelMA的化学结构。(c)1 H NMR(D2O)明胶和GelMA的核磁谱。粉红色和淡粉红色分别代表甲基丙烯酰和赖氨酸信号。(d)GelMA组成、交联时间和每组的平均刚度。右图显示了代表性的压缩应力应变曲线。C和T分别表示GelMA含量和交联时间。(e)接种在水凝胶上的BMM的活/死染色显示均匀分布,所有组中几乎没有死细胞。(f)通过MTT测量细胞活力(n=3)。深色虚线代表平板上细胞的活力。
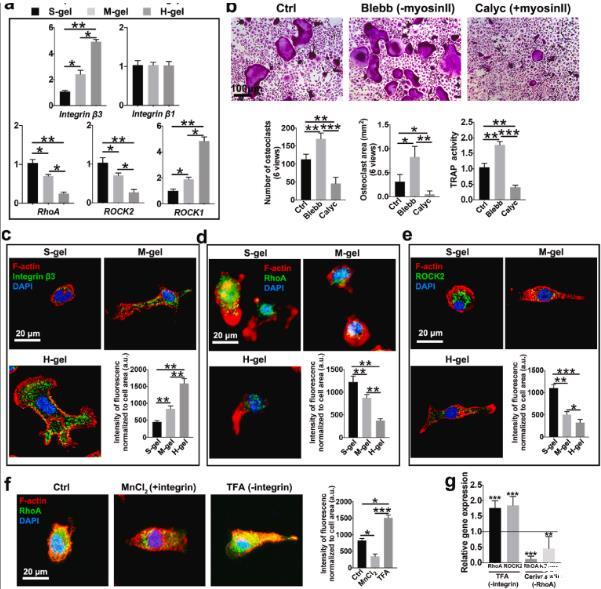
图2、H-gel促进整合素β3表达并减弱RhoA信号传导。(a)指定水凝胶上的相对机械转导mRNA表达(n=3)。(b)M-gel组培养的破骨细胞的代表性TRAP染色图像。对破骨细胞数量(n=6)、破骨细胞面积(n=6)和TRAP活性(n=3)进行量化。Blebb:用blebbistatin培养细胞以抑制肌球蛋白II活性。Calyc:用花萼蛋白A处理细胞以激活肌球蛋白II活性。(c)具有不同硬度的水凝胶上RANKL刺激的细胞中F-肌动蛋白(红色)、整合素β3(绿色)和细胞核(蓝色)荧光染色的代表性图像(n=6)。(d)RANKL刺激细胞在所示水凝胶上染色的F-肌动蛋白(红色)、RhoA(绿色)和细胞核(蓝色)的荧光显微照片和分析。(e)在不同硬度的水凝胶上孵育BMM 3天后,用F-肌动蛋白(红色)、ROCK2(绿色)和细胞核(蓝色)染色的细胞的代表性免疫荧光图像和分析(n=6)。(f)F-肌动蛋白(红色)、RhoA(绿色)和细胞核(蓝色)的免疫荧光染色和分析。将细胞在96孔玻璃板上孵育。氯化锰2、整合素激活剂。TFA,整合素抑制剂。(n=6)。(g)用所示抑制剂处理后RhoA和ROCK2的相对基因表达。
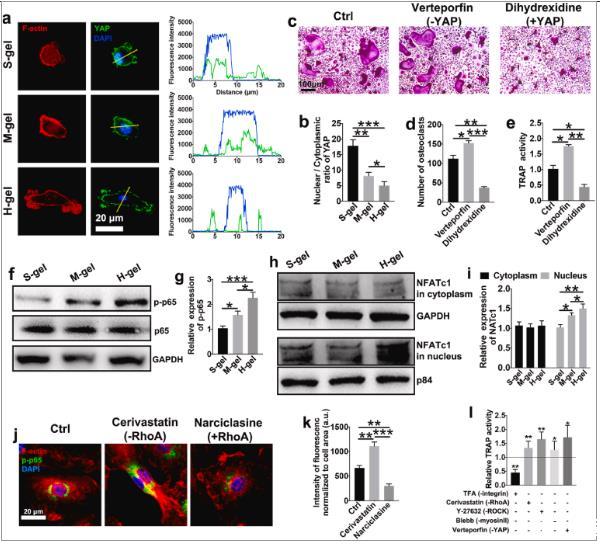
图3、H-gel损害机械感应,从而促进NF-κB信号传导。(a)YAP(绿色)、F-肌动蛋白(红色)和细胞核(蓝色)染色的代表性免疫荧光显微照片。线图显示黄色箭头指示的区域的YAP和DAPI共定位。(b)YAP核定位通过核/细胞质荧光强度的比率来测量。(n=6)。(c)用维替泊芬(YAP抑制剂)或二羟西定(YAP激动剂)处理的破骨细胞的代表性TRAP染色图像。细胞在M-gel组上孵育。(d)量化与指定试剂一起孵育的破骨细胞的数量。(e)测量TRAP活性。(f)在RANKL存在下在所示水凝胶上孵育15分钟后,对单核细胞/巨噬细胞磷酸化p65的相对水平进行蛋白质印迹分析。(g)p-p65水平与总p65水平的量化(n=3)。(h)检测细胞质(GAPDH作为细胞质加载对照)和细胞核(p84作为核加载对照)中的NFATc1水平,并(i)进行定量(n=3)。(j)RANKL刺激的BMM中F-肌动蛋白(红色)、p-p65(绿色)和细胞核(蓝色)的代表性免疫荧光染色。西立伐他汀,RhoA抑制剂。水仙环素,RhoA激活剂。(k)p-p65荧光强度的量化,标准化为细胞大小(n=6)。(l)在H-gel上与M-CSF和RANKL一起孵育3天后,用所示抑制剂处理细胞过夜,然后进行TRAP活性测量。
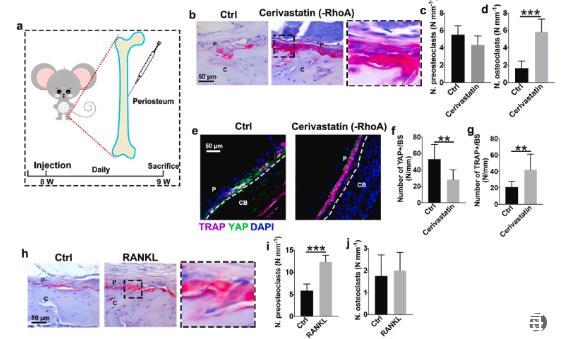
图4、抑制力传导促进骨膜上破骨细胞的生成。(a)骨膜注射西立伐他汀和RANKL的图示。治疗1周后,取出股骨并用TRAP和YAP染色以评估力转导和破骨细胞发育。(b)代表性TRAP染色图像,右图显示西立伐他汀组中黑色轮廓区域的放大。(c)骨膜骨表面前破骨细胞和(d)多核破骨细胞的定量(n=6)。(e)TRAP(紫色)、YAP(绿色)和DAPI(蓝色)的代表性免疫染色图像。CB和P代表皮质骨和骨膜。(f)骨膜上YAP+细胞的数量(n=6)。(g)TRAP+的数量骨膜上的细胞(n=6)。(h)RANKL处理的骨膜的TRAP染色图像,右图显示RANKL组中黑色轮廓区域的放大。(i)骨膜骨表面上的前破骨细胞和(j)破骨细胞的定量(n=6)。P和C分别代表骨膜和皮质骨。
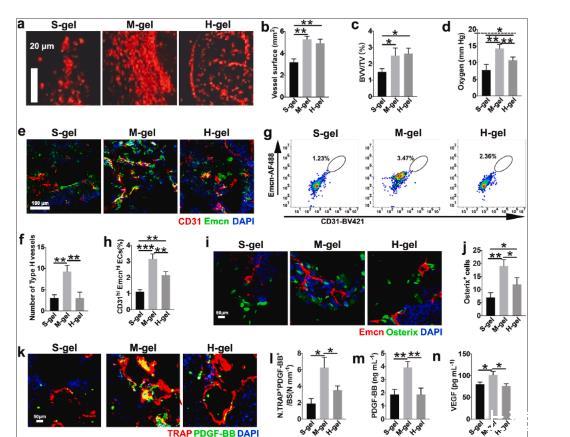
图5、M-gel通过前破骨细胞促进血管生成和骨生成。(a)骨缺损血管造影的代表性图像。(b)容器表面的量化(n=6)。(c)血管体积的相对定量(n=6)。(d)植入8周后,通过尖端直径为100μm的微电极(Unisense,丹麦)测量骨缺损中的氧分压张力(n=6)。虚线代表正常骨髓中的氧分压。(e-f)CD31(绿色)、内粘蛋白(Emcn)和DAPI(蓝色)的代表性免疫染色图像和分析。具有CD31 hi Emcn hi(黄色)的细胞代表植入2周后的H型血管(n=6)。(g–h)流式细胞术图和CD31 hi Emcn百分比分析hi内皮细胞(n=6)。(i–j)Emcn(红色)、Osterix(绿色)和DAPI(蓝色)的免疫染色。骨修复2周后对Osterix+细胞进行定量(n=6)。(k–l)用TRAP(红色)、PDGF-BB(绿色)和DAPI(蓝色)染色的免疫荧光图像。植入2周后骨缺损骨表面PDGF-BB+和TRAP+细胞数量的定量(n=6)。(m)植入2周后骨缺损中的PDGF-BB水平和(n)VEGF水平(n=6)。
结论与展望
破骨细胞普遍参与骨稳态,其异常会导致骨疾病,例如骨质疏松症。由于破骨细胞的不受控制的管理,当前的生化信号分子临床策略经常扰乱先天骨代谢。因此迫切需要一种精确调节破骨细胞分化的替代策略。为此,本研究提出了一个假设,即机械刺激可能是一种潜在的策略。在这里本论文研究人员创建了一种水凝胶来模仿生理骨骼微环境,其刚度范围为2.43kPa至68.2kPa。彻底研究了基质刚度对破骨细胞行为的影响。结果表明,基质硬度可用于在体外和体内指导破骨细胞的命运。特别是增加的基质硬度抑制了整合素β3响应的RhoA-ROCK2-YAP相关的机械转导并促进破骨细胞生成。值得注意的是,中等硬度水凝胶(M-gel)具有与血管相同的刚度(范围为17.5 kPa至44.6 kPa),通过部分抑制力传导来促进前破骨细胞发育,从而促进骨缺损小鼠的血运重建和骨再生。此研究工作提供了一种通过选择最佳基质刚度来精细调节破骨细胞分化的创新方法。
 相关新闻
相关新闻