热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
2.2 AuNPs/CFME在体检测芦荟多糖
将CFME和Ag/AgCl参比电极置于纳米金溶胶中,恒定电压下电沉积适当时间。经AuNPs修饰后的CFME在pH=7.0的PBS缓冲溶液中,芦荟多糖的循环伏安曲线的氧化峰电流值明显增大(见图6)。
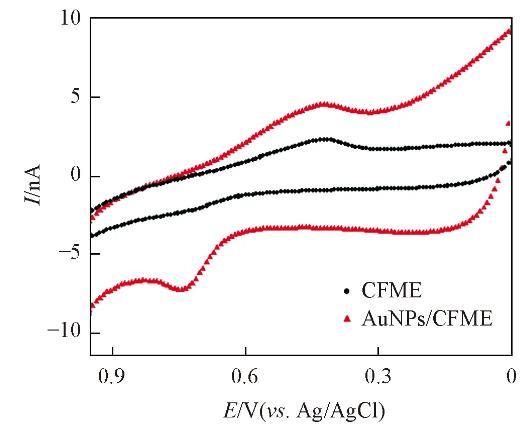
将AuNPs/CFME电极应用于芦荟植株在体检测,由图7可见,CFME经纳米金修饰后在芦荟储水凝胶组织中检测芦荟多糖的电化学稳定性明显增强,通过比较6次循环伏安扫描曲线中氧化峰和还原峰电流的变化得出其相对标准偏差(RSD)值<10%.这说明CFME经纳米金修饰后,降低了电化学动态监测芦荟多糖水平的干扰。
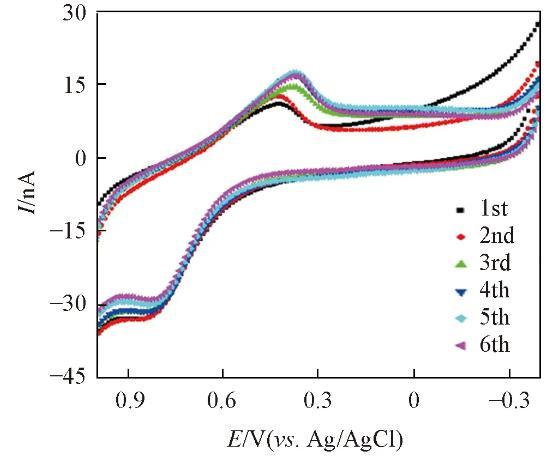
从纳米金修饰前后CFME监测芦荟多糖的循环伏安叠加图(图8)可见,纳米金修饰后电极对芦荟多糖的电化学响应显著增加,而且氧化峰电流的位置无明显偏移,说明修饰后的电极对芦荟多糖有良好的电催化效果。

2.3 AuNPs/CFME的电化学阻抗谱及电化学活性面积分析
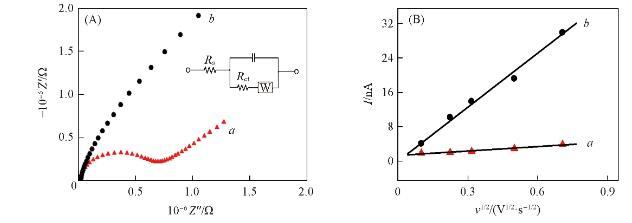
采用电化学阻抗谱(EIS)对修饰过程中电极的阻抗值变化进行了考察。在EIS谱测定过程中,以[Fe(CN)6]3-/[Fe(CN)6]4-作氧化还原探针,阻抗谱半圆直径等于电子转移电阻Ret.结果如图9(A)所示,谱线a和b分别为CFME和AuNPs/CFME的EIS谱线,频率范围0.05 Hz——100 kHz.裸CFME的Ret值非常大,约为5.913×105Ω,而AuNPs/CFME的Ret值明显减小,约为10-3Ω.这是由于纳米金粒子的表面效应及表面原子的空位效应使纳米金粒子具有高活性,修饰电极表面被一层纳米金粒子覆盖,降低了电极的界面阻抗值。电极的电活性区域是评估电极性能的重要参数,以多巴胺为氧化还原探针通过循环伏安法测定了修饰电极的有效表面积。对于可逆过程,采用Randles-Sevcik方程计算电极的电活性面积:
Ip=2.69×105An3/2D1/2v1/2c
式中:A(cm2)为工作电极的有效电活性表面积;n为反应中的电子转移,该值等于2;D为在确定的溶液中指探针分子的扩散系数,约为9.145×10-7cm2/s;υ(V/s)表示扫描速率,c(mol/L)对应于氧化还原探针的浓度,在该反应中检测到的分子浓度为10μmol/L;Ip(nA)代表氧化还原电流峰值。由Ip对v1/2线性方程[图9(B)]的斜率计算得出CFME和AuNPs/CFME的表面积分别为4.123×10-7和5.498×10-6cm2,AuNPs/CFME的微观电活性面积是裸CFME的13.334倍。上述结果表明,与CFME相比,AuNPs/CFME具有更大的比表面积,从而可提供更多的电化学活性位点。综上,AuNPs/CFME电化学性能提高是修饰电极大的比表面积、优良电导率以及AuNPs粒子的催化活性共同作用的结果。
2.4 CFME修饰条件的优化
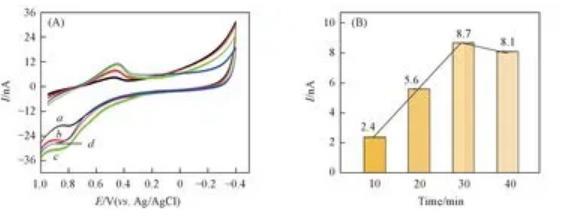
采用循环伏安法考察了修饰电极电沉积时间对芦荟多糖电化学响应的影响。如图10所示,设定初始恒定电压为1.5 V,随着电沉积时间的延长,芦荟储水组织中芦荟多糖电化学的响应也随之增强,当沉积时间达30 min时,芦荟多糖的氧化峰电流达到最大值,继续增加电沉积时间,芦荟多糖的氧化峰电流下降,故选择最佳电沉积时间为30 min.
2.5不同光照条件下芦荟多糖的含量变化
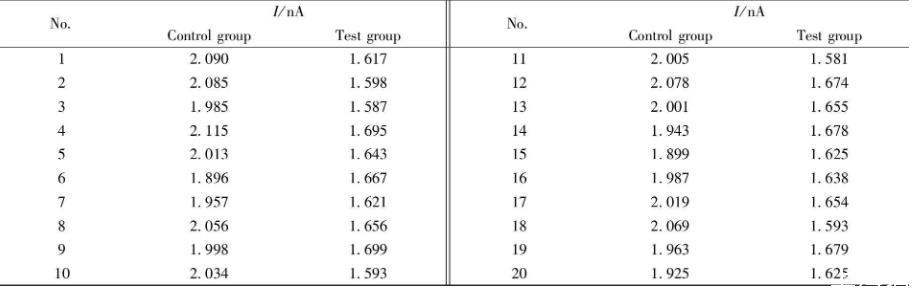
分别设置对照组和实验组,对照组为正常光照环境下的芦荟植株,实验组为在黑暗环境下放置2 d的芦荟植株(与对照组所用植株相同)。将纳米金修饰后的CFME与参比电极插入芦荟叶片的储水凝胶组织中,进行电化学检测,在不同叶片位置平行检测20次,表1列出了测定结果。图11为对照组和实验组分别进行20次电化学响应实验的柱状图,可以看出对照组的电化学响应均明显高于实验组(P<0.01),对照组和实验组的氧化峰电流值具有统计学差异,说明无光条件下芦荟多糖的含量比正常光照环境下明显降低,可用于衡量芦荟植株光合作用程度。

3结论
建立了一种动态监测不同生长环境下活体芦荟植株中芦荟多糖浓度水平的电化学方法,通过在基底电极界面修饰纳米金粒子增强其对芦荟多糖的电化学响应,可更灵敏地监测芦荟多糖的浓度变化。结果表明,不同光照环境下生长的芦荟植株中芦荟多糖的变化具有显著的统计学差异,可作为衡量芦荟光合作用强度的指标之一,为进一步研究芦荟植株应对不同外界环境体内各种激素水平变化提供了论据。
 相关新闻
相关新闻