热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
研究简介:子痫前期是一种严重的妊娠并发症,其特征之一是高血压和蛋白尿。循环中可溶性fms样酪氨酸激酶-1(sFlt-1)水平的升高被认为是导致这些症状的主要原因之一。sFlt-1是血管内皮生长因子(VEGF)受体的可溶性分泌形式,能够作为VEGF和胎盘生长因子(PlGF)的拮抗剂,导致内皮功能障碍。硫化氢是一种内源性气态信号分子,与多种生理和病理过程有关,包括血管扩张、血管生成和炎症。胎盘组织能够产生H2S,而H2S的产生与γ-半胱氨酸裂解酶(CSE)和β-半胱氨酸合成酶(CBS)等酶的活性有关。除了已知的CSE和CBS,3-巯基丙酮酸硫基转移酶(3-MST)也在人类胎盘中被发现,并且主要定位于合胞滋养细胞。研究发现,H2S能够抑制胎盘中sFlt-1的释放。本研究进一步探讨了内源性H2S对sFlt-1生成的影响,以及在胎盘中发挥作用的H2S生成酶。miR133b是一种小RNA分子,参与了H2S抑制sFlt-1生成的过程。研究发现,H2S处理能够降低sFlt-1 mRNA的半衰期,并增加miR-133b的表达。本研究旨在阐明内源性H2S如何影响sFlt-1的生成,并探讨了miR133b在这一过程中的作用,以及H2S生成酶在胎盘中的表达和功能。
Unisense微呼吸系统的应用
将约100毫克的胎盘组织或培养细胞样本放入含有蛋白酶抑制剂,2毫摩尔苯甲基磺酰氟、1毫摩尔正钒酸钠和10毫克/毫升阿普罗宁)的PBS中,置于冰浴上。组织匀浆后在4℃温度下离心,然后收集上清液。使用微型H2S微呼吸电极(H2S-MRCh型,Unisense,丹麦)和Unisense PA2000放大器测定H2S生成的实时动力学(Zhu等,2013年)。简而言之,测量是在温控微呼吸系统(Unisense)中进行的。传感器信号稳定后,加入L-半胱氨酸(1mmol/L)和产生H2S的辅助因子吡哆醛-50-磷酸(PLP,1mmol/L)。然后在每个痕量的最初最陡斜坡处测定H2S生成率。
实验结果
研究获得的RIA、NKA丰度、rOCR和长度缺乏差异表明,白鲈幼虫能够应对OA,而在暴露于OA时,离子传输能力、能量消耗或生长不会发生重大变化。预计下个世纪的pCO 2会升高(~2000µatm)。然而,深入的分析为潜在的新效应提供了线索,例如离子细胞大小的变化,并有助于确定需要对海洋鱼类幼虫的基本生理学、它们响应OA和多重应激源的能量分配以及通过亲本效应、发育可塑性和自然选择实现跨代适应的潜力。这凸显了根据急性实验室研究来确定OA对海洋生物的潜在影响的难度。
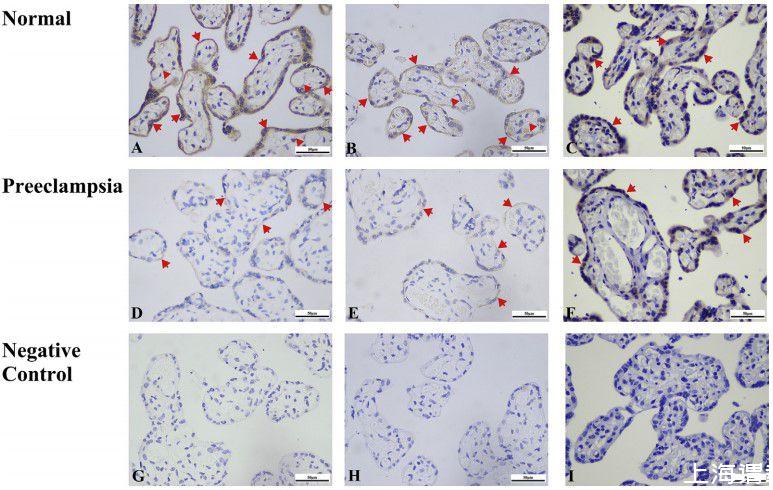
图1、CBS、CSE和3-MST在人类胎盘中的表达。A-F:免疫细胞化学分析显示了健康胎盘和子痫前期胎盘中CBS(A&D)、CSE(B&E)和3MST(C&F)阳性染色的代表性切片。G-I为阴性对照切片,使用的一抗与过量10倍的相应阻断肽(G&H)或IgG(I)预孵育。
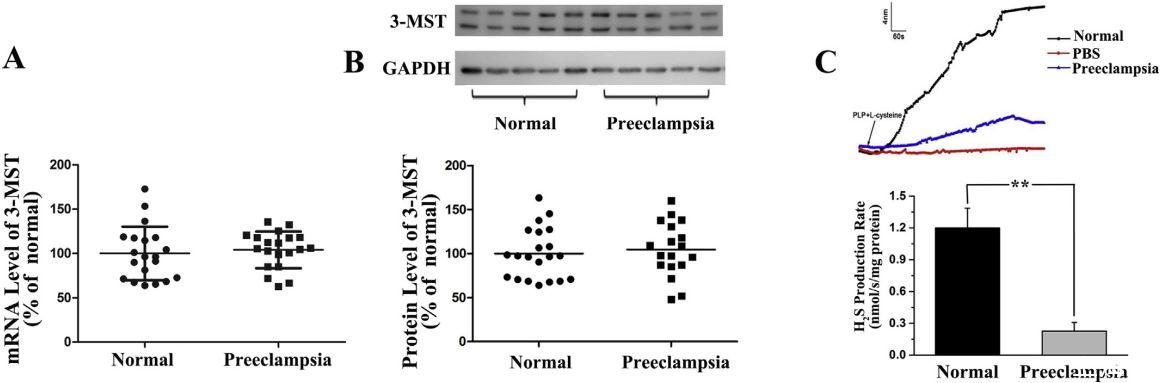
图2、健康胎盘和子痫前期胎盘中的3-MST含量和H2S生成率。胎盘组织取自健康孕妇(n=23)和子痫前期孕妇(n=19)。A:通过实时RT-PCR检测3-MST的mRNA水平。B:用Western印迹法测定3-MST的蛋白水平。具有代表性的蛋白条带显示在相应直方图的顶部。C,正常胎盘和子痫前期胎盘的H2S生成率。上图为胎盘组织匀浆中H2S生成的代表性痕迹。下图为正常胎盘和子痫前期胎盘中H2S生成率的累积数据。

图3、H2S调节人胎盘细胞中sFlt-1的产生。A和B,NaHS和L-半胱氨酸对培养的胎盘细胞中sFlt-1生成的影响。用酶联免疫吸附法测定培养基中sFlt-1蛋白水平。实时RT-PCR检测细胞中sFlt-1的mRNA水平。C,L-半胱氨酸对敲除CBS或CSE的细胞中sFlt-1生成的影响。用对照siRNA、CBS siRNA或CSE siRNA转染细胞,然后用L-半胱氨酸(2×10-3M)处理24小时。
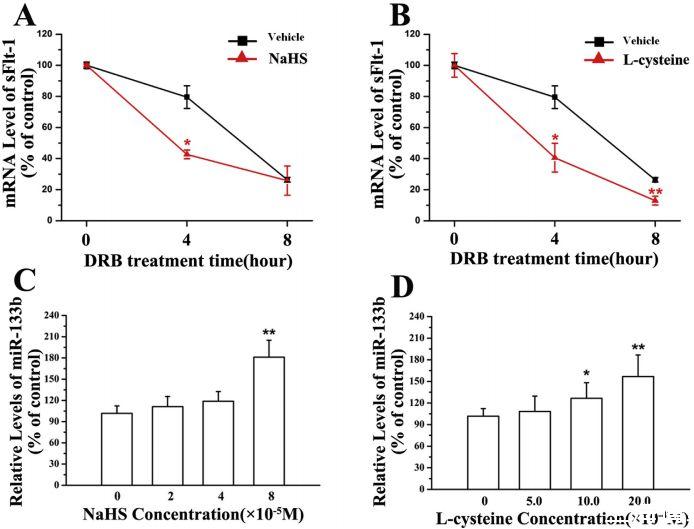
图4、H2S对sFlt-1稳定性和miR-133b表达的影响。A&B,mRNA抑制剂DRB对NaHS(A)和L-半胱氨酸(B)处理的滋养细胞中sFlt-1 mRNA表达的影响。用NaHS(8×10-5M)或L-半胱氨酸(2×10-3M)预处理胎盘滋养细胞12小时,然后用DRB(25×10-6M)处理。之后在指定的时间点分离总RNA,并通过实时RT-PCR检测mRNA的稳态水平。18S-RNA用作负载对照。C&D,NaHS(C)和L-半胱氨酸(D)对胎盘滋养细胞中miR-133b表达的影响。用不同浓度的NaHS处理细胞24小时,然后收获细胞测定miR133b的水平。
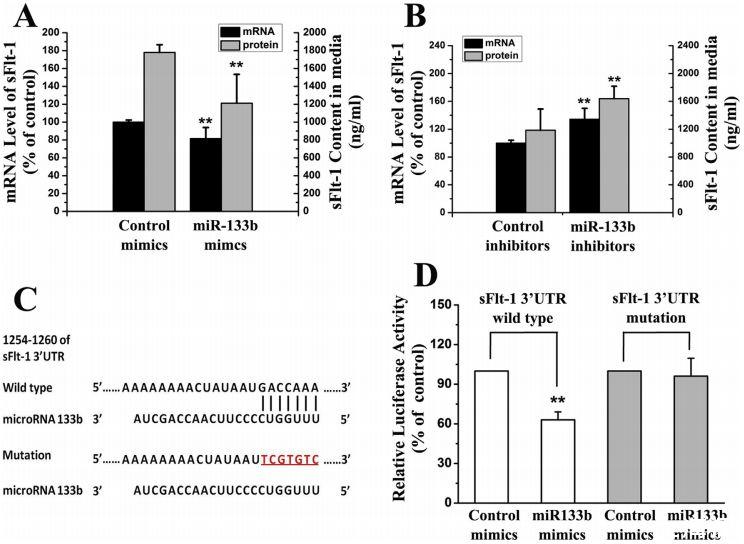
图5、Flt-1是miR-133b的直接靶标。A,miR133b的模拟物对胎盘细胞中sFlt-1基础水平的影响。细胞中sFlt-1的mRNA水平和培养基中sFlt-1的蛋白浓度分别通过实时RT-PCR和ELISA法测定。B,miR133b抑制剂对胎盘滋养层细胞中sFlt-1基础水平的影响。C,sFlt-1 3’UTRs中预测的miR-133b靶序列及其3’UTRs中的突变核苷酸。D,含有sFlt-1 3’UTR及其突变核苷酸的荧光素酶检测报告。在没有或存在miR133b模拟物的情况下,用上述报告物转染胎盘滋养细胞。使用双荧光素酶报告检测系统测量细胞裂解物中的荧光素酶活性。
结论与展望
胎盘中可溶性fms样酪氨酸激酶-1(sFlt-1)的分泌增加是导致子痫前期的主要原因之一。之前的研究表明,硫化氢(H2S)能抑制胎盘中sFlt-1的释放。在本研究中,研究人员试图探究内源性H2S是否会影响sFlt-1的生成,并阐明是哪种H2S生成酶在胎盘中发挥了作用。研究发现除了β-半胱氨酸合成酶(CBS)和γ-半胱氨酸裂解酶(CSE)外,3-巯基丙酮酸硫基转移酶(3-MST)也在人类胎盘中被发现,并且主要定位于合胞滋养细胞。3-MST在先兆子痫胎盘和正常胎盘中的表达水平无明显差异。用NaHS和L-半胱氨酸处理培养的合胞滋养细胞可抑制sFlt-1 mRNA的表达,并导致细胞培养基中的sFlt-1蛋白含量下降。用CBS siRNA和CSE siRNA转染合胞滋养细胞可逆转L-半胱氨酸的上述作用。此外NaHS和L-半胱氨酸处理降低了sFlt-1 mRNA的半衰期,增加了靶向sFlt-1的miR-133b的表达。MiR-133b在先兆子痫胎盘中表达下调,并与CBS和CSE水平相关。Unisense微呼吸系统被用来实时测量胎盘组织或培养细胞样本中硫化氢(H2S)的产量,并能够精确地测量和分析胎盘组织和细胞中H2S的产生情况,这对于理解H2S在胎盘功能和子痫前期发展中的作用至关重要。这些结果表明,H2S是胎盘中产生sFlt-1的重要调节因素。本论文的结论强调了H2S在胎盘中作为sFlt-1生成的重要调节因素,以及CSE和CBS表达量的减少可能是导致先兆子痫胎盘中sFlt-1生成量升高的原因之一。为理解子痫前期的分子机制提供了新的见解,并可能有助于开发预防和治疗这一妊娠并发症的新策略。