热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
研究简介:土壤对大气氢(H2)的氧化是形成大气氧化还原状态的关键生物地球化学过程。直到最近,这还被认为是一个非生物过程,但现在人们认识到,来自至少九个门的多种需氧细菌氧化大气中的H2。土壤对大气氢(H2)的氧化是形成大气氧化还原状态的关键生物地球化学过程1。直到最近,这还被认为是一个非生物过程,但现在人们认识到,来自至少九个门的多种需氧细菌氧化大气中的H2[NiFe]氢化酶构成膜结合H2氧化金属酶家族,支持细菌在富含H2的环境中需氧和厌氧生长;然而,这些酶通常不能氧化大气中的H2,因为它们对H2的亲和力较低。这些氢化酶尚未被分离出来,它们如何进化为选择性氧化H2、耐受O2暴露以及与电子传递链相互作用仍然未知。值得注意的是,负责大气H2氧化的氢化酶是否具有固有的高亲和力,或者它们的亲和力是否通过它们与呼吸链的相互作用来调节存在争议。
为了解决这些知识空白,研究人员研究了需氧细菌耻垢分枝杆菌中大气H2氧化的结构和机制基础。该细菌拥有2种系统发育上不同的氢化酶——Huc(2a组)和Hhy(1h组)——均可将H2氧化至低于大气压的水平。直接从耻垢分枝杆菌中分离出Huc,并确定了其氧化大气H2的结构和生化基础。
Unisense微呼吸系统的应用
使用极化至+100mV持续1小时的Unisense 氢气微电极以电流分析法测量纯化的Huc的H2消耗。最初,用气体饱和缓冲液(50 mM Tris,150 mM NaCl,pH 8.0)中的已知H 2标准物(0%、1%和10%H 2(v/v))校准电极。该缓冲液的制备方法是,首先用100%氮气将所有缓冲液鼓泡1小时,以除去任何痕量的氧气,然后将100%H 2(v/v)鼓泡通过脱氧缓冲液10分钟。在脱气和再脱气之前,所有缓冲液均含有最终浓度为200μM的电子受体(甲萘醌、NBT或苄基紫精)。对于每个读数,1 ml 1%(8µM)H 2将含有电子受体的注入缓冲液添加到微呼吸测定室中,直至最终浓度为1%H 2。随后将电极放入室中进行平衡。平衡后(大约10分钟),通过针将BSA(0.3 mg ml-1)和Huc(0.3 mg ml-1 BSA中的1–3 nM)添加到腔室中,以免破坏溶液中的气体平衡。使用SensorTrace Suite v3.4.00测量H 2浓度的变化,并且测量从添加Huc直到完成H2消耗的H2消耗的线性速率。H2线性速率计算八个时间点内约2.5μM H 2至0.0125μM H 2浓度之间的Huc消耗量。
实验结果
为了利用空气中存在的痕量H2,微量气体清除细菌的[NiFe]氢化酶需要与在富含H 2的缺氧或缺氧条件下发挥作用的对应物相比具有不同的特性。通过对来自需氧细菌耻垢分枝杆菌的Huc的生化和电化学表征,研究表明了所需的O 2不敏感性和对H 2高亲和力的特性。是这种氢化酶固有的,而不是由于与细菌细胞内的其他过程耦合而产生的。通过确定Huc的冷冻电镜结构、分子动力学模拟以及FTIR和EPR光谱,我们提供了强有力的证据,证明活性位点至少部分排除O 2有助于酶的O 2不敏感性。我们的数据表明,Huc具有较大的电化学过电势,使其能够独特地调节痕量H 2的氧化以及将产生的电子直接捐赠给呼吸辅助因子甲基萘醌。证明了Huc通过一种独特且极不寻常的机制来获取甲基萘醌。通过支架蛋白HucM,Huc复合物可以从膜中提取甲基萘醌并将其运输94Å至酶的电子受体位点。
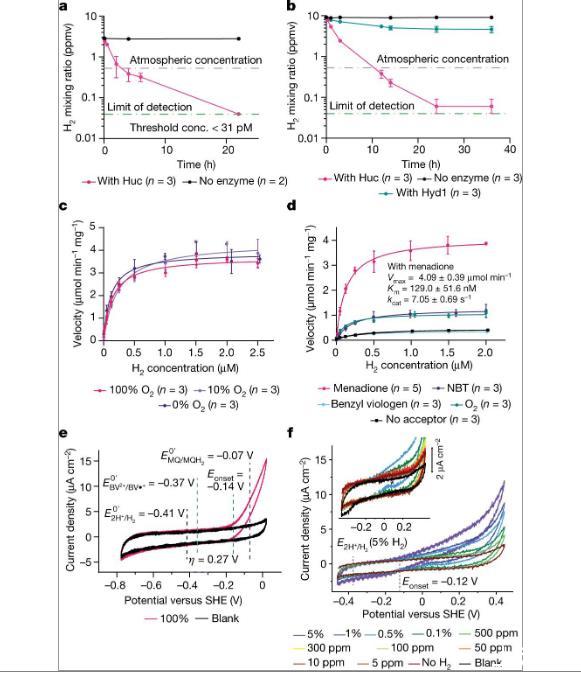
图1、Huc是一种高亲和力的O2不敏感氢化酶。a)用200μM甲萘醌作为电子受体,对含有Huc或不含酶的密封小瓶顶部空间的H2浓度进行气相色谱分析。Huc可以将低于大气浓度(紫线)的H 2氧化至检测限(绿线)。浓度,浓度。b)用200μM NBT作为电子受体,对含有Huc、大肠杆菌Hyd1或不含酶的小瓶进行气相色谱分析。c)Huc在不同O 2饱和百分比的缓冲液中氧化H2的Michaelis-Menten动力学。d)具有不同电子受体的缓冲液中Huc H2消耗的Michaelis-Menten动力学,脱气但含有痕量O2。e)固定化Huc蛋白膜在100%H2气氛中的循环伏安图。f)用包含氩气、N 2和指示水平的H2的气体混合物冲洗顶部空间的固定化Huc蛋白膜的循环伏安图。

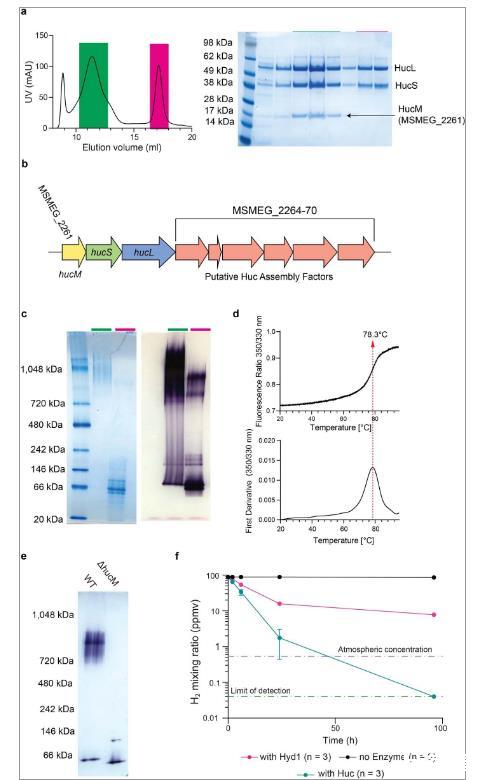
图2、a)Huc寡聚物的冷冻电镜密度图,显示其四个叶,每个叶包含两个HucSL二聚体,四个位于中心的HucM亚基充当寡聚物的支架。b)由4个HucM亚基(残基20至79)形成的中央四聚体的卡通表示,其中单个HucS 2 L 2叶显示为上下文的表面模型。c)Huc低聚物的不对称单元的卡通表示。d)复合冷冻电镜密度图,显示Huc“体”区域,以及与细胞膜外围相关的“茎”区域。e)HucM C末端区域(残基80至189)的AlphaFold2模型的卡通表示,显示它形成四聚体卷曲螺旋管。f)卡通图,显示根据冷冻电镜结构重建的完整Huc复合物以及适合茎区域冷冻电镜密度图的HucM C末端AlphaFold模型。
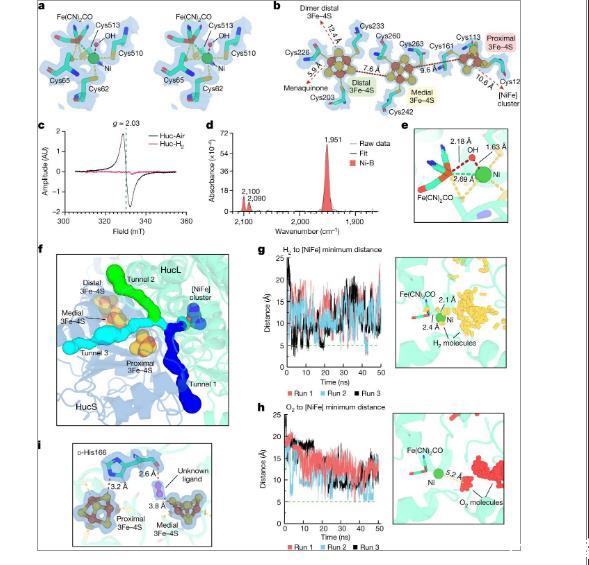
图3、a)环境空气下Huc[NiFe]星团的立体图。b)三个HucS[3Fe-4S]簇的结构。c)处于分离的氧化态(Huc-Air)和H 2还原态(Huc-H 2)的Huc的高温(30K)EPR光谱。g=2.03处的各向同性信号(g是朗德因子)与氧化的[3Fe–4S]+簇有关,由于簇的还原,该信号在Huc-H 2中消失。在H2处理形式的Huc中没有可辨别出归因于还原的[4Fe–4S]+簇的信号。d)环境空气中分离的氧化Huc的FTIR光谱,表明酶的[NiFe]活性位点采用与Ni-B状态一致的氧化状态。e)Huc[NiFe]活性位点,显示Ni-B态羟基配体与簇中Ni和Fe离子之间的相对距离。f)HucSL二聚体,显示了疏水性气体通道的位置和宽度,该通道提供底物进入[NiFe]活性位点。g)左图,距离与时间的关系图,显示在H 2存在的情况下进行HucSL分子动力学模拟过程中,H2与Huc[NiFe]活性位点之间的最近距离。h)与g类似,但显示了在存在O2的情况下进行的HucSL模拟中O2相对于Huc[NiFe]位点的位置。i,HucL D-His166与近端和内侧[3Fe-4S]簇的接近度以及未知配体的位置。
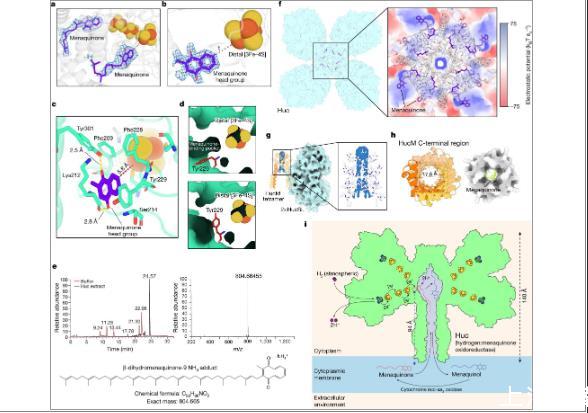
图4、a)Huc低聚物的低分辨率冷冻电镜重建中与Huc结合的甲基萘醌对应的密度。b)对应于Huc二聚体高分辨率冷冻电镜图中结合甲基萘醌的密度。由于掩蔽和对称性平均,这些图中没有甲基萘醌尾部的密度。c)在远端[3Fe-4S]簇的电子转移距离内,HucS亚基对甲基萘醌头基的协调。d)在高分辨率Huc冷冻电镜密度图中观察到HucS的Tyr229的两种构象。Tyr229在甲基萘醌存在时采用开放构象(顶部),而在甲基萘醌结合时采用互斥的闭合构象(底部)。e)对纯化Huc中的Folch提取物进行高效液相色谱-质谱(LC-MS)分析。基峰色谱图(左)显示在24.6分钟处有一个实质性峰,对应于m/z=804.66455(右)处的离子,这与β-二氢甲基萘醌-9的铵加合物一致,m/z=804.66531(下)。f)中心腔体Huc的混合棒和静电表面表示,表明腔体表面衬有疏水残基。g)HucM四聚体的视图,显示了封闭Huc内部疏水室顶部的脂质密度的存在。HHucM C端管的自上而下视图,显示管的内部排列有疏水残基(左),并且可以容纳甲基萘醌分子(右)。i0Huc还原甲基萘醌的模型,使用大气H2氧化产生的电子。
结论与展望
本研究工作提供了一种通过选择最佳基质刚度来精细调节破骨细胞分化的创新方法。多种需氧细菌利用大气中的H2作为生长和生存的能源。这一具有全球意义的过程可调节大气成分、增强土壤生物多样性并推动极端环境下的初级生产。大气H2氧化归因于[NiFe]氢化酶超家族的未表征成员。然而这些酶如何克服在环境水平的催化毒物O2中氧化皮摩尔水平的H2的非凡催化挑战以及衍生的电子如何转移到呼吸链仍然悬而未决。在这里研究人员确定了耻垢分枝杆菌氢化酶Huc的冷冻电子显微镜结构Huc是一种高效的氧不敏感酶,可将大气中H2的氧化与呼吸电子载体甲基萘醌的氢化结合起来。Huc使用狭窄的疏水性气体通道以牺牲O2为代价选择性地结合大气中的H2,并且3个[3Fe–4S]簇调节酶的特性,从而使大气中的H2氧化在能量上是可行的。Huc催化亚基在膜相关茎周围形成八聚体833 kDa复合物,从膜上转运并还原甲基萘醌94Å。这些发现为大气H2氧化的生物地球化学和生态学重要过程提供了机制基础,揭示了依赖于长程醌传输的能量耦合模式,并为开发氧化环境空气中H 2的催化剂铺平了道路。本研究的极大地扩展了对减少呼吸醌的可能性的认识。这些发现为生物催化剂的开发开辟了途径,因为迄今为止在全细胞和纯化酶系统中应用的所有氢化酶都是被O2抑制的低亲和力酶。Huc作为一种对氧不敏感的高亲和力酶和第2族[NiFe]氢化酶,为开发在环境条件下运行的生物催化剂提供了基础。
 相关新闻
相关新闻