热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
景介绍:大多数肿瘤在生长过程中会出现不同程度的乏氧,而乏氧是导致肿瘤转移和耐受的重要原因之一。因此在肿瘤治疗中清除乏氧肿瘤细胞对预防肿瘤复发和转移尤为重要。乏氧依赖性药物则是在乏氧条件下起效的一类物质,主要包括乏氧性细菌、乏氧性前药(如:沙门氏菌、替拉扎明)等。这些物质可与其他抗肿瘤手段联合,清除乏氧肿瘤细胞,防止肿瘤复发和转移。然而临床上联合乏氧依赖性药物对肿瘤的疗效并不理想,这主要是由于肿瘤的乏氧部位渗透性差,药物浓度过低所导致的。尽管已经有一些手段可增加乏氧药物的渗透性,然而渗透性增加必然伴随着氧气浓度增加,反而降低了乏氧药物的疗效。本研究报道了一种全氟碳纳米颗粒(PNPs)可以用来创建一个持久穿透性和低氧肿瘤微环境,探索这种材料全氟化碳在临床肿瘤治疗应用的一个新方向。
Unisense微电极系统的应用
应用了Unisense氧气微电极穿刺老鼠肿瘤组织内1mm深处的氧气浓度。同时结合氧微电极测试了老鼠体内注射PNPs(全氟碳纳米颗粒)后并应用激光照射后测试老鼠肿瘤组织内的氧气浓度。其中氧微电极采用传统的2点法进行校正。
实验结果
研究表明全氟碳纳米颗粒(PNPs)可以用来创建一个持久穿透性和低氧肿瘤微环境,以确保实施的HBA的激活。全氟碳纳米颗粒(PNPs)除了能够增加乏氧药物的渗透性,还可以保留PNPs,进一步实现长期抑制瘤内O2再灌注,同时增强HBA的积累。研究证明了该纳米粒可通过光动力效应破坏血管,增加肿瘤部位的药物渗透,同时还作为一种“吸氧海绵”,将渗透进入肿瘤组织的氧气,富集并消耗完毕,为乏氧依赖性药物创造了能够起效的乏氧微环境。
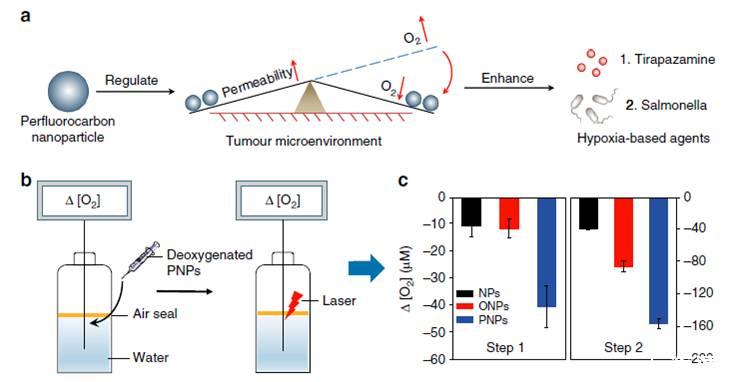
图1、PNP介导的HBA和O2吸收及消耗功能的改善示意图。图a表示的是PNP粒子增强了基于缺氧的药物疗效。PNPs可以增强肿瘤的渗透性和长期缺氧,从而提高HBA的疗效。图b表示的是PNPs O2吸收/消耗能力测定示意图(瓶子内溶解的氧浓度使用了unisense氧微电极测试获得)。图c表示采用了unisense微电极定量测定体系中溶氧浓度的DO变化情况(n=3)。
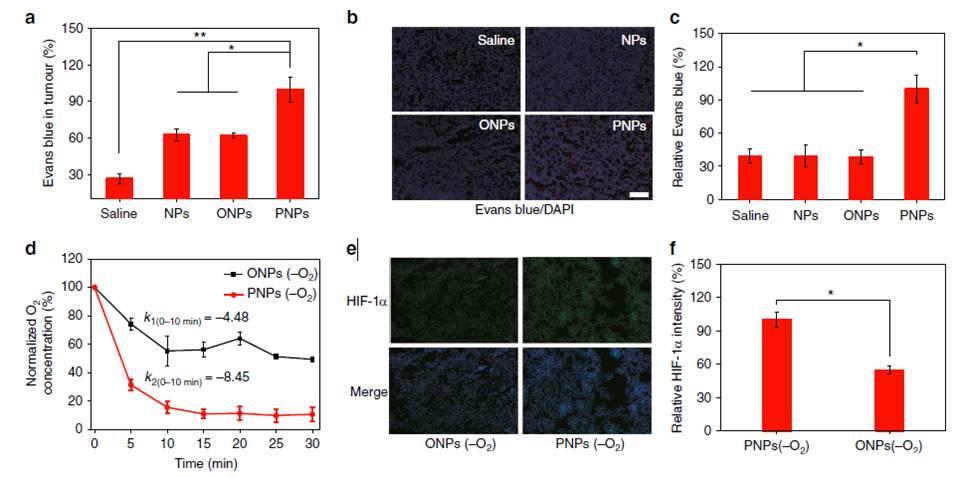
图2、体内缺氧PNPs介导的渗透性增强和缺氧的长期效应。图a)肿瘤中埃文斯蓝积累的分析,24小时后静脉注射脱氧PNPs。用紫外-可见分光光度法(UV-vis)测定肿瘤中埃文斯蓝的含量。图b)体外荧光图像的伊文思蓝(红色)和4‘,6-二脒基-2-苯基吲哚(DAPI)(蓝色)染色(图中的比例尺存是100μm)。图c)定量Evans蓝在b中的累积量。图d肿瘤内注射脱氧PNPs和油纳米颗粒后溶氧(DO)的变化。图e)肿瘤内注射缺氧PNPs和ONPs(比例尺寸,100μm)24小时后体现的免疫荧光图像的低氧factor-1α(HIF-1α)(绿色)染色部分。(f)量化HIF-1α表达数。
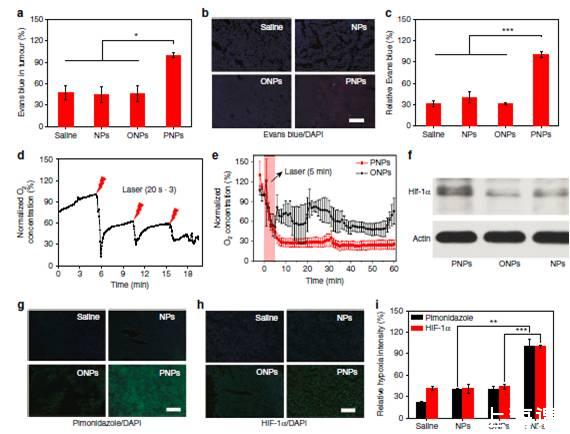
图3、在激光照射下,PNPs的脱氧作用增加了肿瘤的通透性和缺氧。图a表示的是静脉注射PNPs 24 h,激光照射3 h(5min,808 nm,400mWcm−2),肿瘤中埃文斯蓝的积累。图b体外荧光伊文思蓝的图像(红色)在肿瘤部分。图c.b中Evans蓝积累的相对定量(n=4)。图d肿瘤内给药后,在三个周期的激光照射(808 nm,2Wcm-2)后肿瘤内的溶解氧(DO)变化情况。图e)静脉注射后24小时,激光照射(808 nm,400mWcm-2)5分钟后肿瘤内DO的变化。f免疫印迹图(肿瘤内低氧factor-1α(HIF-1α)表达在激光辐照后24小时。g,h肿瘤切片沾抗哌莫硝唑抗体(绿色),anti-HIF-1α抗体(绿色)和DAPI(蓝色)在24 h后辐照(比例尺寸、200μm)。
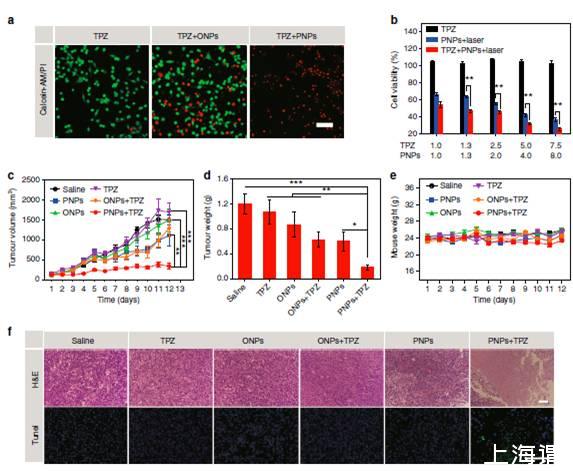
图4、PNPs增强TPZ化疗法。用TPZ和油纳米粒子(ONPs)或PNPs粒子在激光下培养CT26细胞的荧光图像,激光辐射(808 nm,400mWcm-2)。活细胞用Calcein-AM染色(绿色),死亡/晚期凋亡细胞用碘化丙钠染色(π)(红色),(比例尺寸,100μm)。图b)治疗组细胞存活率。图c)治疗组小鼠肿瘤生长曲线(n≥6/组)。PNPs和TPZ都是第1、3和5天分别静脉注射到小鼠体内。图d)肿瘤重量在第12天归一化平均。图e)动物体重的变化。图f)苏木精和伊红(H&E)(比例尺寸、100μm)和末端转移酶的dUTP缺口末端标记(TUNEL)(绿色)(比例尺寸、规模100μm)CT26肿瘤染色。试样的样品都是在第8天收集不同组别的样本.
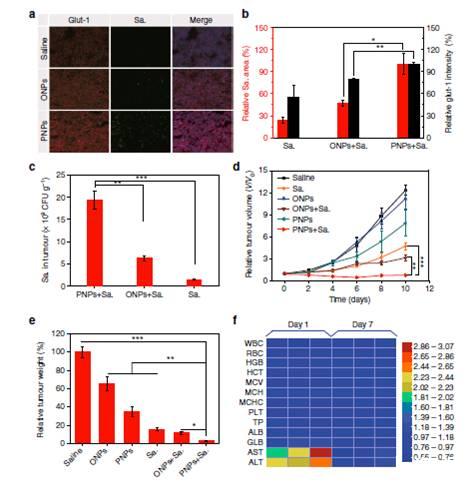
图5、PNPs使基于缺氧的细菌性癌症治疗成为可能。图a)低氧强度、沙门氏菌VNP20009(Sa.)积累量和细胞核数。用抗glut1抗体(红色)、抗sa染色测定,抗体(绿色)和4′,6-二氨基-2-苯基吲哚(DAPI)(蓝色)100μm)。Sa(5×106 CFU)于照射前1 h静脉给药。将小鼠置于808 nm、400mWcm−2激光下,照射时间为静脉注射PNPs、油纳米粒(ONPs)或生理盐水后min(24h)。肿瘤切片免疫荧光图像。图b)相对低氧强度(黑色y轴)和Sa的半定量分析。图c。Sa的分布。在第3天(n=3),用集落形成法测定小鼠肿瘤生长曲线(n=4-9)。图e治疗后第10天肿瘤的量恢复正常。小鼠血液学指标和血液生化指标均有显著性差异静脉注射VNP20009。实验在注射VNP20009后和生理盐水后的第1天和第7天进行的。
总结
临床上联合乏氧依赖性药物对肿瘤的疗效并不理想,这主要是由于肿瘤的乏氧部位渗透性差,药物浓度过低所导致。为了在增加药物渗透的同时,降低氧气的渗透,研究人员发明了一种全氟化碳纳米粒。该纳米粒可通过光动力效应破坏血管,增加肿瘤部位的药物渗透,同时还作为一种“吸氧海绵”,将渗透进入肿瘤组织的氧气,富集并消耗完毕,为乏氧依赖性药物创造了能够起效的乏氧微环境。本论文发明了一种全氟化碳纳米粒子,该纳米粒可通过光动力效应破坏血管,增加肿瘤部位的药物渗透,同时还作为一种“吸氧海绵”,将渗透进入肿瘤组织的氧气,富集并消耗完毕,为乏氧依赖性药物创造了能够起效的乏氧微环境。具体方法将全氟化碳纳米粒子PNPs注入到老鼠体内,全氟化碳纳米粒子能够与药物共同作用降低肿瘤中的氧气浓度,创造乏氧环境,全氟化碳纳米粒可显著增加乏氧药物的疗效,实验中使用了unisense氧微电极用于原位的测试老鼠肿瘤组织中的氧气浓度实现了对于老鼠体内的氧气浓度的在线监测,从而提出了基于全氟化碳纳米粒子缺氧剂能够增加乏氧药物的疗效的相关机理,研究采用的全氟化碳纳米粒对机体的组织器官没有毒性,安全可靠,极有可能成为全氟化碳在临床应用的一个新方向。这说明unisense氧微电极在医学缺氧肿瘤临床应用方面存在着很好的应用前景。