热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
为了简化穿透MEA的空间布置,在下文中,3D MEA将指包含多个突出微电极或穿透轴的MEA。因此,已经使用微电子制造技术制造了用于连接神经元组织的各种类型的3D MEA,其主要涉及在基底的顶部或底部表面上沉积或生长电极材料(例如金属、碳、陶瓷等)。近年来,MEA制造方法扩展到还包括使用喷墨打印作为图案化工具直接在聚二甲基硅氧烷(PDMS)、琼脂糖和明胶基材上制造软MEA,这也允许快速原型制作方法。此外,喷墨印刷已用于在平面MEA基板上制造3D微电极。通过打印纳米粒子,开发了轴高度、直径和路径任意变化的高密度3D MEA,并将其应用于体内实验。此外,立体光刻3D打印已与金属电极的油墨铸造和电镀相结合,用于在孔板中制造3D MEA。尽管如此,这些方法的印刷分辨率有限,低至数十微米,需要具有高杨氏模量的导电油墨,从而导致更高的横截面足迹,并且缺乏或需要额外的步骤来实施用于钝化印刷电极的绝缘层。
用于神经元记录的高度可定制的3D微电极的制造
我们为两种互补的应用模式开发了高度可定制的3D MEA,以允许体外(图1A)和体内(图1B)方法进行神经元记录。对于体外方法,3D柱电极直接集成在芯片上,并保留平面MEA的传统功能,例如易于硬件集成。该芯片是一种独立设备,可用于球体、类器官和急性神经切片的电生理记录。相比之下,体内方法的灵感来自植入式神经探针的部署,其中3D MEA被插入神经组织中。由于其灵活的设计,体内方法也可用于针对3D神经组织的体外应用。
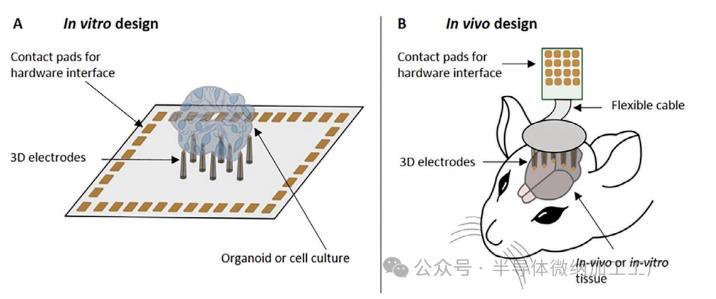
Fig1:3D MEA的应用方式。A)体外设计通常将培养皿和3D MEA直接集成在芯片上,代表可用于球体、类器官和急性神经切片的独立设备。B)体内设计将MEA与神经元组织分离,其中MEA单独制造在(柔性)基板上,并通过倒装芯片粘合到印刷电路板上。连接到显微操作器后,可以在体外和体内实验中降低探针以穿透神经元组织。
3D MEA的制造仅包含三个主要步骤:
平面MEA的制造、3D空心聚合物柱的印刷以及导电材料的电化学沉积。
首先,通过传统(或无掩模)光刻工艺制造刚性或柔性平面MEA(图2Ai)。然后调整微电极的尺寸、间距和排列以适应不同的实验要求。对于刚性平面MEA,形成微电极、互连件和接触垫的导电钛/金/钛(Ti/Au/Ti)层沉积在绝缘基板(二氧化硅或玻璃)上,并用SU-8覆盖绝缘。对于柔性平面MEA,导电Ti/Au/Ti层嵌入两个聚对二甲苯-C(PaC)层(每层5µm厚)之间。对于两种MEA类型,顶部钝化层和Ti层在接触焊盘和微电极开口处被蚀刻,从而暴露Au表面。在下一步(图2Aii)中,使用2PP和生物相容性32-34光树脂(例如IP-L)在刚性或柔性平面MEA的电极位置打印中空聚合物柱(Nanoscribe GmbH&Co KG,埃根施泰因-利奥波德港,德国)。为了增强基于2PP的结构和平面MEA之间的粘附力,通过在空心柱的底部添加3µm厚的环形聚合物盘(也称为基板)来扩大接触面积。然后将基板-柱元件的开口与微电极对齐并打印在平面MEA的顶部,将两者无缝打印为一个相干元件。因此,通过添加直径为50–100µm的基板,或者在节距较窄的情况下,添加与打印区域窗口匹配的连续基板,支柱的接触面积增加了30.5–124倍(参见实验部分)。最后,同时作为模板和钝化层的聚合物柱通过电化学沉积填充金(图2Aiii),然后通过聚(3,4-乙撑二氧噻吩)的电聚合沉积电极涂层帽):聚苯乙烯磺酸盐(PEDOT:PSS)。
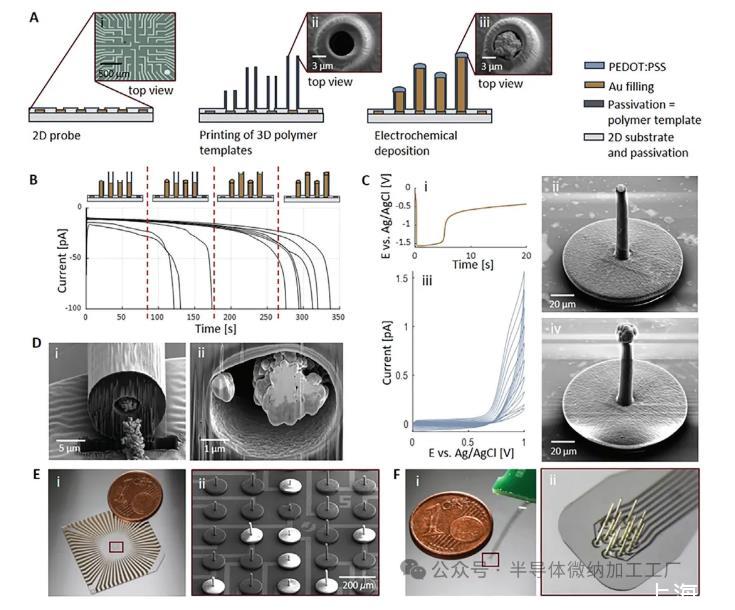
Fig2:3D MEA的制造。A)通过打印3D聚合物模板(A ii)以及模板辅助电沉积Au和PEDOT:PSS在平面MEA基板(A)上制造3D电极。通过仔细控制电流,可以在柱的顶部形成帽(A iii)。B)模板辅助电化学沉积金在高度为35和65µm的直柱内。在计时电流法过程中,使用-1.3 V的恒定电势。电流-时间曲线展示了用Au填充不同高度的柱子的电化学沉积过程的四个阶段,当测量的电流开始呈指数增加时停止,从而表明Au填充到达柱子的顶端。C)在第二个沉积步骤中,电流固定在-100 nA持续20 s(C),以创建光滑且小的金帽(C ii)。以下PEDOT:PSS沉积通过循环伏安法进行2-10个循环(在(C iii)中循环数为10),具体取决于PEDOT:PSS帽的所需尺寸(C iv)。D)聚焦离子束(FIB)-在底部切割一根单独的柱子,显示柱子的壁厚约为4µm(D)和顶端(D ii)。E)制造结果显示了刚性3D MEA装置(E)和具有不同高度(40–100µm)3D打印柱的阵列的放大图片(E ii))。F)制造结果显示灵活的3D MEA(F)和高度为500µm的3D打印柱的放大图片(F ii)。

制造纵横比高达33:1且电极直径小至8µm的3D打印柱电极(表1;图S1,支持信息),从而超越高达11的纵横比:1和电极直径小至10µm,如文献中所述,使用2PP印刷工艺时30,31所提出的技术允许制造定制且可单独寻址的中空聚合物柱(例如,电沉积过程中),因此提供了最大的灵活性,以满足不同用例的要求。鉴于2PP提供的定制功能,任何所需的柱形状仅受高纵横比的限制,高纵横比由柱模板的高度与外径和柱间距之间的比率定义。因此,可以打印同一MEA上具有不同高度的柱(图2Eii;图S1B,支持信息),并且无需额外的努力即可实现多站点柱设计(图S5,支持信息),以便从不同的神经层记录同时(参见第2.3节),因此可以在我们的MEA设备中实现微电极的3D空间排列。此外,正如FIB切割分析所示,由于柱底部的空心柱的壁厚为4µm而不是2µm(图2Di),柱子表现出更高的稳定性,正如理论上所预期的那样。
最后,我们还探索了在不同基材上打印的可能性,发现在PaC等透明聚合物上打印是可行的。因此,我们能够在刚性平面玻璃MEA顶部制造用于体外应用的3D电极(图2E),以及用于体内应用的柔性PaC基板(图2F)。3D MEA的成功制造取决于五个主要加工特征:印刷界面的识别、未交联2PP光树脂的正确显影、印刷品与平面MEA的对齐、2PP光树脂和电沉积溶液的保质期,以及执行该过程的环境条件。
在2PP工艺中,找到基材-光树脂界面非常重要,因为它决定了打印的起始焦点。不正确的打印接口可能会影响打印的最终高度,例如,柱子变短,或导致粘附问题。此外,未开发的柱子和印刷的未对准是错误的来源,可以防止金盐溶液进入柱子内部并接触平面MEA上的微电极。此外,2PP光树脂的光学稳定性(由保质期决定)和稳定的环境条件可能会导致打印参数发生变化,例如激光功率和扫描速度的调整。
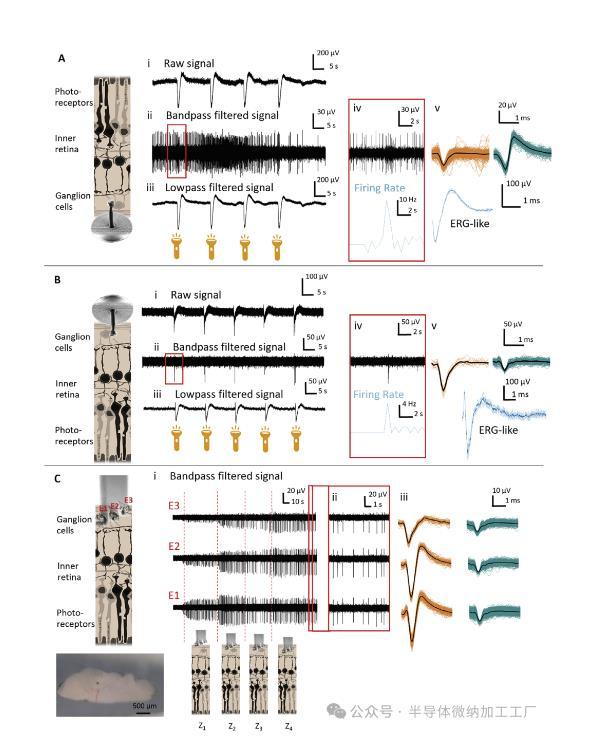
Fig3:摘除啮齿动物视网膜的体外记录。使用体外A)和体内B)方法进行视网膜记录,显示原始电信号(A-B)、尖峰活动(带通滤波信号)(A-B ii)和局部场电位(低通滤波信号)(A-B iii)在光学刺激下捕获。A和B中各个光学响应的快照表明,尖峰信号(黑色迹线)的放电速率(蓝色迹线)在光刺激时增加(A-B iv)。在(A-B v)中显示了不同的神经波形。此外,在这两种情况下,记录了代表视网膜总活动的四到五个刺激的平均ERG波形(蓝色)。C)插入包含三个电极的多位点柱,每个电极的高度差为20µm。记录显示逐步插入后多部位柱的视网膜内放置(Z 1–Z 4)。此外,还显示了Z 4(C ii,红色窗口)处的记录提取物和单个多位点柱内各个电极(C iii)捕获的尖峰波形。
观察到超大PEDOT:PSS电极涂层的机械不稳定性(例如,十个CV循环后),在急性视网膜内插入时,其会在与柱内金线的界面处断裂。尽管如此,通过减小导电聚合物帽的尺寸(例如,在两个CV循环后),可以防止PEDOT:PSS电极涂层的碎裂,从而产生坚固的涂层,在多次插入和超过10次的重新插入后显示出机械和电化学稳定性。使用(图S8A,支持信息)。因此,多位点探针证明,即使是稍微过度生长的帽,在插入超过10次时也是稳定的。虽然多次插入后,一些3D微电极的阻抗增加,但大多数PEDOT:PSS帽仍然完好无损,并且约85%的电极保持了适合神经记录的电化学特性(图S8B,支持信息)。尽管如此,如果在插入和缩回时对探头不轻柔,则可能存在材料残留的风险(图S8B ii,支持信息)。无论如何,如果在制造过程中精确控制PEDOT:PSS帽的形成,这种风险就会大大降低(图S4,支持信息)。此外,鉴于其在生物组织中的多种用途,正如预期的那样,在电极之间遇到了视网膜组织残留物(图S8A ii,支持信息)。因此,对于重复使用,必须进一步研究清洁方案的实施情况。
结论与展望
在这项工作中,我们提出了一种新颖、简单、多功能且高度可定制的3D MEA制造工艺,可产生高纵横比的3D微电极,用于研究复杂的3D神经元系统。我们使用基于2PP的3D光刻工具将空心柱印刷到不同的平面MEA基板上,使用柱作为模板引导Au和PEDOT:PSS等导电材料的电化学沉积,从而使2D电极生长成第三维度。与文献30,31中报道的其他方法相比,我们的过程的新颖性依赖于使用空心柱而不是实心柱的想法。因此,在单个光刻步骤中产生的空心柱具有引导电化学沉积和钝化导电材料的双重目的。因此,将平面MEA基板修改为3D MEA的制造步骤被最小化,因为只需要两个后处理步骤即可实现导电柱:印刷空心柱,用作后续电沉积的模板导电材料。
同样,我们的方法在加工方面具有通用性和可重复性,因为可以在刚性(石英上的SU-8)和柔性(PaC)MEA基板上以不同的设计制造3D MEA。因此,2PP印刷的可定制性以及在不同基材材料上实现印刷的可能性,以及在技术上使用不同的电沉积导电材料(例如Pt、PEDOT:PSS),使得该工艺能够轻松适应任何电极几何形状,并且具有具有可部署在任何平面MEA设备上的潜力。因此,制造3D微电极的电化学驱动工艺也可以作为后处理步骤来实现,例如将3D刺激/记录微电极与CMOS技术集成。在这种情况下,可以在平面芯片中使用CMOS兼容封装和薄膜层(例如钛和钨)的使用,以阻止金属接触(例如Au或Pt)扩散到硅中,从而使金属接触电极和通孔互连是可能的,57使得所提出的工艺与CMOS技术兼容。
 相关新闻
相关新闻