热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
近几十年来,新兴的神经刺激手段,如脑深部电刺激(DBS)、经颅磁刺激(TMS)、经颅直流电刺激(tDCS)等,已在临床和实验室研究中用于治疗癫痫。其中,无创经颅磁刺激治疗癫痫的研究越来越受到国内外研究者和临床医师的关注。研究表明,20~100Hz的电磁刺激(EMS)对持续部分性癫痫有积极的治疗作用。影响癫痫的磁场刺激的另一个关键参数是磁刺激的持续时间(即刺激脉冲的数量)。研究表明,3000个脉冲的磁刺激减少了23%的癫痫发作,1500个脉冲减少了3%。虽然这些研究证明不同模式的磁刺激可以调节EFA过程,但其强度和时间依赖性的微观效应无法实时记录。
使用无镁人工脑脊液(ACSF)建立的癫痫样活动(EFA)模型已经成为一种被广泛接受的颞叶癫痫模型。近年来的研究表明,癫痫发作开始前存在从短暂的发作问期放电(IIDs)到延长的发作期放电(IDs)的过渡过程。然而,EMS是否会影响IIDs向IDs的转变尚未被研究。
因此,为了进一步解决上述这类问题,天津工业大学 提出了基于多电极阵列记录的实时电磁刺激对癫痫样活动的调制作用及电磁刺激用于癫痫放电模型研究的可行性,并进一步确定了其对海马的不同强度和时间效应。
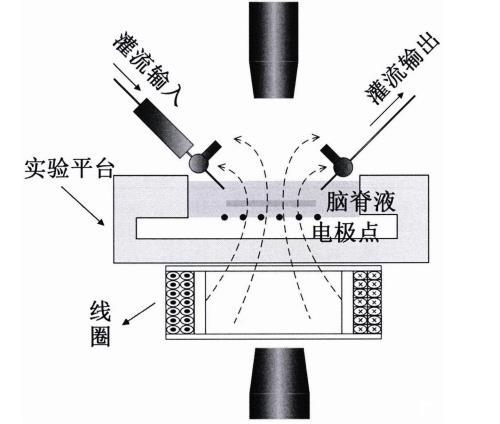
(1)构建大鼠癫痫模型
采用持续灌流低水平镁离子(Mg2+被从正常人工脑脊液中移除,其他离子浓度不变)的人工脑脊液ACSF来诱发癫痫样放电活动,这种方式构成的颞叶癫痫实验模型现在被广泛接受。实验前1h,对大鼠进行称重和深度麻醉。将大鼠迅速断头置于4℃的冰枕中,并置于准备好的0℃ACSF中3分钟,以确保大脑处于低代谢水平。ACSF提前10min注入95%O2/5%CO2。将左脑和右脑分别放在4℃的冰枕上,然后将它们放回0℃的ACSF中。取出左(或右)脑区,放入模具中,用冰夹夹住。用配置好的36℃液体琼脂将脑切片固定在模具中。将模具固定在振动组织切片机上进行切片。选取海马CA1、CA3和DG区完整的脑片,转移到孵育槽中,在32℃含95%O2/5%CO2的ACSF中孵育至少2h。
(2)微电极阵列(MEA)记录诱发的癫痫样活动EFA
多电极阵列电生理记录系统主要由MEA主机、灌注系统和温度控制器组成。实验过程中,将孵育的海马脑片从孵育槽快速转移到玻璃电极上,然后将玻璃电极放入MEA2100-60中。合理调整海马脑片位置,确定每个海马脑片区域对应玻璃电极的64个记录点。灌注系统使用前10min持续向ACSF注入95%O2/5%CO2的混合液,以保证脑片的活性和正常代谢能力。同时打开温控器,确保MEA2100记录平台和灌注液的温度保持在37℃。
(3)实时EMS的实验设置与应用
用于产生磁场的线圈由铜线制成,缠绕在有机玻璃框架上。磁刺激线圈驱动器由数据采集卡和自制功率放大器组成。输入波形为内间隔10ms的脉冲信号,刺激脉宽也为10ms。逆时针设置磁圈电流,将脑片置于磁圈上方约7mm处。在一段时间内记录到稳定的EFA事件后,添加高、低峰对峰输入电压的100hz EMS(设定不同持续时间)。
(4)数据分析及处理
无镁ACSF灌注10~15min后,电极阵列系统可记录到海马CA1、CA3和DG区锥体细胞层异常同步癫痫样放电,并逐渐进入稳态。每个EFA都涉及从IIDs到IDs的转换。记录过程中,海马脑片自发放电信号峰值超过背景标准差4倍,连续放电时间超过300ms的事件被识别为EFA。将连续放电时间<300ms的癫痫事件定义为IIDs(交互放电),连续放电时间>2000ms的癫痫事件定义为IDs(工业放电)。采用MEA配套分析软件对数据进行分析和处理。实验收集的数据通过数字导出,使用MATLAB和Origin 9.0软件进行处理和统计分析。采用单因素方差分析确定试验组间差异,组间多重比较采用Tukey′s post-hoc检验进行校正。
(5)不同模式对癫痫放电活动的调控作用
记录稳定的EFA事件一段时间后,加入低峰值和高峰值输入磁场强度的实时脉冲磁刺激,低强度实时磁场干预5分钟可降低IDs的幅度,IDs事件仍然存在,而高输入电压实时磁场干预5分钟可降低IDs的频率和幅度,IDs事件已被完全抑制,短时高、低输入强度磁场对EFA无影响,实时磁场可以阻断从IIDs到IDs的正常EFA过程,即一个完整的EFA循环,这种抑制效果与输入强度和干预时间有关。此研究进一步提出了磁刺激作为抗癫痫替代疗法的可能性。
 相关新闻
相关新闻