热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
在神经科学研究中,微电极阵列(Microelectrode Arrays,MEAs)技术已成为探索神经网络动态的强大工具。MEA技术能够非侵入性地记录多个神经元的电活动,为研究神经网络的复杂动态提供了重要的实验手段。然而,MEA技术在应用过程中面临一些挑战,尤其是在与三维(3D)神经组织(如神经类器官)的界面兼容性方面。由于MEA表面通常是平面的,而3D神经组织的结构复杂,如何有效地将神经元靠近电极以记录微弱的细胞外信号成为了一个关键问题。此外,MEA技术在提高信号记录精度和稳定性方面仍有待进一步改进。尽管已有研究通过改进MEA表面处理来提升其性能,但对如何从介质侧改善组织~MEA相互作用的研究相对较少。因此,如何在不损伤组织的前提下,增强MEA与3D神经组织的接触面积和信号记录质量,成为了一个亟待解决的科学问题。本研究通过引入一种生物相容的氟化溶剂——全氟癸烷(Perfluorodecalin,PFD),探索了其在增强MEA电生理测量中的潜力。PFD具有高度疏水性和化学稳定性,能够有效地绝缘和压缩神经组织,从而显著提高电生理记录的信号质量和稳定性。这一创新方法不仅为MEA技术在神经科学研究中的应用提供了新的思路,也为未来神经网络功能和连接性的体外研究开辟了新的途径,具有重要的科学价值和应用前景。
在神经科学研究中,如何提高微电极阵列(MEA)与三维(3D)神经组织的界面兼容性,以增强电生理信号的记录质量,是一个重要的科学问题。研究者们猜想,通过在神经组织与MEA之间引入一种生物相容的绝缘介质,可以有效地压缩和绝缘神经组织,从而提高MEA的电生理测量性能。为此,研究者们采用了一种名为全氟癸烷(Perfluorodecalin,PFD)的氟化溶剂,探索其在增强MEA电生理测量中的潜力。PFD具有高度疏水性和化学稳定性,能够有效地绝缘和压缩神经组织。
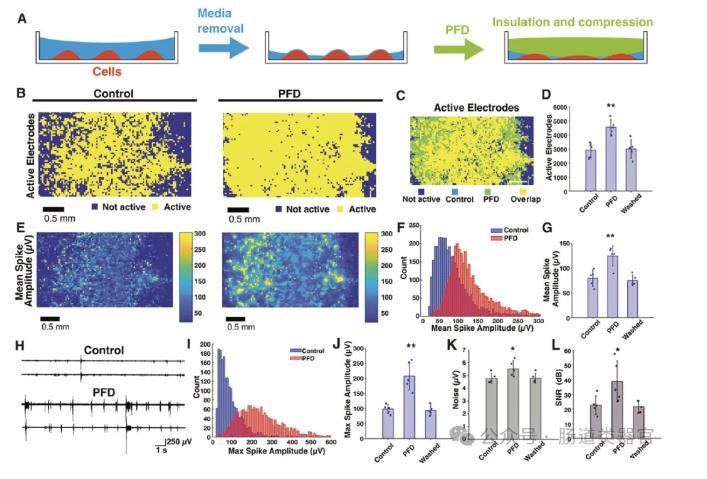
研究思路是将PFD覆盖在神经组织上,通过其密度大于培养基的特性,使PFD自然下沉并压缩神经组织,从而增加神经组织与MEA的接触面积。实验中,研究者们首先在小鼠原代海马神经元上验证了PFD的效果,发现PFD能够显著增加活性电极的数量和电位幅度(图1B-D)。具体而言,PFD条件下的活性电极数量显著高于对照组,并且在PFD洗脱后,活性电极数量恢复到对照组水平,表明PFD的效果是可逆的(图1D)。此外,PFD条件下的平均尖峰幅度也显著高于对照组(图1E-G),最大尖峰幅度平均增加了两倍(图1H-J),同时信噪比(SNR)显著提高,达到56 dB(图1L)。这些结果表明,PFD通过绝缘和压缩神经组织,显著提高了MEA的电生理记录性能。
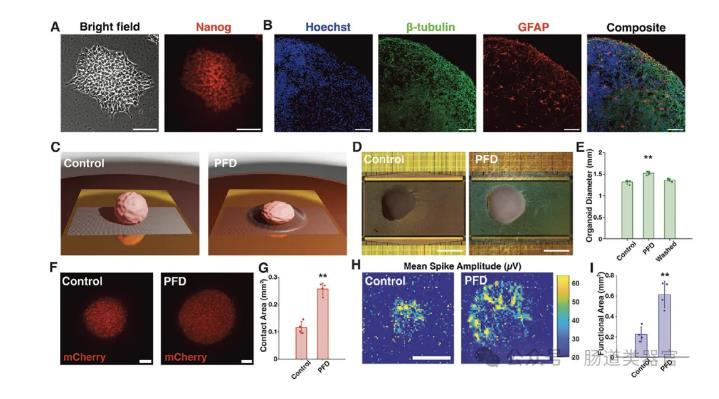
在进一步的研究中,研究者们将PFD应用于3D神经组织——脑类器官。结果显示,PFD能够显著增加脑类器官的直径(图2D-E),并通过增加与MEA的接触面积来提高电生理信号的记录质量(图2H-I)。在PFD条件下,脑类器官的网络爆发活动得到了显著增强,活性电极数量、平均和最大尖峰幅度以及信噪比均显著提高(图3C)。此外,PFD的应用还增强了神经网络的检测能力,新的尖峰排序单元出现,单单元尖峰对之间的相关性增加(图3E)。这些结果表明,PFD不仅提高了信号的幅度,还增强了对神经单元和连接的检测能力。
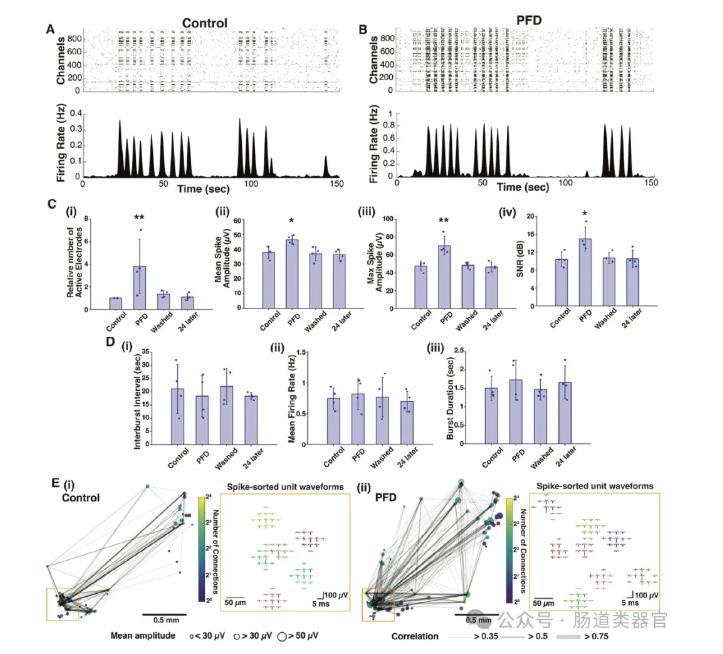
总结而言,PFD作为一种生物相容的氟化溶剂,通过绝缘和压缩神经组织,显著提高了MEA的电生理记录性能。
这一方法不仅适用于慢性培养的细胞,还可以稳定和记录急性培养的组织,为神经科学研究提供了一种新的工具。然而,研究也发现PFD的应用可能会增加背景噪声水平(图1K),这提示在实际应用中需要进一步优化PFD的使用条件,以减少可能的干扰。此外,PFD的光学透明性使其与光遗传学技术兼容,为研究神经活动提供了更多的可能性。未来的研究可以进一步探索PFD在不同类型的神经组织中的应用效果,以及如何结合其他技术手段,进一步提高MEA的电生理测量精度和稳定性。
在这项研究中,类器官芯片的培养步骤主要包括以下几个方面:首先,从人类诱导多能干细胞(hiPSCs)中获取细胞,然后将这些细胞在特定的培养条件下进行培养和分化,以形成具有特定细胞类型和组织结构的类器官。具体来说,hiPSCs在含有特定生长因子和化学物质的培养基中进行培养,这些因子和化学物质能够引导细胞向特定的神经细胞类型分化。随着培养时间的延长,细胞逐渐形成具有复杂结构和功能的类器官,如脑类器官。这些类器官能够模拟真实大脑的某些发育过程和功能特性,为研究大脑发育、疾病机制以及药物筛选等提供了重要的实验模型。