热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
花器官液泡pH对花色的影响
在花青素类观赏植物中,显色物质组成相同,显色物质存在的状态不同,呈现的花色不同。保持这类植物显色物质稳定性的方式有花色苷的自缔合作用和花色苷与辅色素结合的共色素沉着作用。自缔合作用中多个花青素发色团叠加在同一个左旋轴上,不同角度的迁移导致分裂的圆偏光二色性曲线产生,即光谱有不同的红移或蓝移趋势(图1);共色素沉着是显色物质疏水堆积使结构稳定,对花色苷与辅色素浓度、种类有要求,即浓度越高,疏水力越强,显色物质越稳定,颜色可由红向蓝紫移动。这些全部依赖于一定的液泡pH,液泡pH改变时水合能力改变,着色物质为适应水合环境,调整自身使其稳定,颜色发生改变。合适的花色苷与辅色素形成共色素沉着后,还可避免花色苷不稳定的无水碱基形成甲基醇从而不显色,且pH在3-6的区间内辅色素槲皮苷才能和花色苷、金属离子形成络合物。
大豆紫花胞液pH为5.73-5.77,而蓝花胞液pH为6.07-6.10。类似地,矮牵牛红色花花瓣匀浆pH在5.5左右,而紫色花瓣匀浆pH在6.0左右;飞燕草花瓣表皮组织在紫红色时pH为5.5,紫蓝色时pH为6.6。另外,一些植物花瓣液泡的pH也显示出类似的变化趋势。日本牵牛从花蕾到绽放,花瓣液泡pH一直升高,花蕾时期紫红色的细胞液泡pH为6.6,而开花后蓝色细胞液泡的pH为7.7;同样,在八仙花上,用质子选择微电极精准测量着色细胞液泡,蓝色花的液泡pH均值为4.1,而红色花为3.3。葡萄风信子的穗状花序上半部分为蓝色,下半部分为紫色,紫色部分的匀浆pH为5.84,蓝色部分为5.91。葛根花序上同时有不同时间开放的花,新开的花为紫红色,pH为5.2,老花为紫罗兰色,pH为5.5。
自然界中没有蓝色月季花,月季的DRF基因无法将二氢杨梅酮作为底物反应生成飞燕草素花色苷,致使无蓝色月季的诞生。研究人员在试验了多种月季品种后选择了辅色素含量和液泡pH均高的品种作为寄主,将三色堇的F3′5′H基因与荷兰鸢尾的DFR基因构建二元载体导入寄主,在月季DFR基因SiRNA表达的共同作用下,寄主花瓣最终呈现淡紫色。这对蓝色月季的培育具有里程碑式的意义。由此可以得出结论,除飞燕草素花色苷外,较高的液泡pH与高含量的辅色素也是蓝色月季花形成必不可少的元素,这两个重要因子在在仙客来、菊花和康乃馨上同样有所印证。
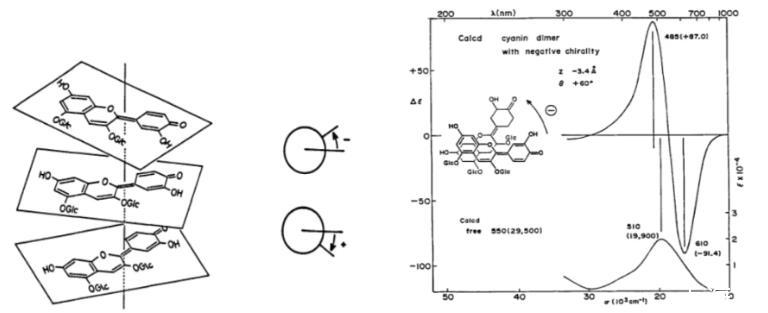
图1花色苷堆积偏旋模式及CD曲线展示
调控花器官液泡pH的分子机理
在水稻和玉米上发现,将原来的pH为5.0的营养液调至pH为8.5,两种作物根部液泡pH均出现一定的下降趋势,5-10 min后恢复原来的pH;在玉米营养液中加入NH3,使营养液pH升至8.5,玉米根部液泡pH由5.5左右升至6.1左右,并稳定下来;在水稻营养液中加入NH3,水稻根部液泡pH由5.4左右升至5.9左右,很快恢复至pH为5.4左右,并趋于稳定,这表明液泡具有一套隔离外界环境、独立调控内部pH的系统。
由于着色细胞液泡的pH在花色调控中起重要作用,因此研究调控花器官液泡pH的分子机理对于花色调控具有非常重要的价值。前人在调控着色细胞液泡pH的研究中,以日本牵牛与矮牵牛作为模式植物,阐明了着色细胞液泡碱化与酸化的分子机理。
液泡酸化
野生型矮牵牛花冠呈红色,矮牵牛突变体出现与原有表型有色差的扇形色块,或花冠整体颜色偏紫。研究发现,不同颜色区域,其液泡pH也不同。
通过进一步分离杂交实验,共分离出PH1-PH7 7个调控着色细胞液泡pH酸化的基因。其中PH4编码R2R3 MYB蛋白(myeloblastosis蛋白),PH6(后更名为AN1)属于bHLH蛋白(basic helixloop-helix蛋白),这两个蛋白与WDR蛋白(WD是由40个氨基酸组成,以色氨酸W、天冬氨酸D结尾的结构域;WDR是WD重复)AN11结合,形成MBW(MYB-bHLH-WD)复合物,调节花青素晚期合成通路;PH4-AN1-AN11还激活PH3转录,PH3编码WRKY蛋白(含WRKYGQK 7个保守的氨基酸序列和16个氨基酸的锌指结构域的转录因子),可与AN11绑定,与PH4-AN1-AN11形成复合蛋白,在前馈环中转录PH5,同时,PH1也受PH4-AN1-AN11以及PH3的调控(图2)。PH5表达还受AN2转录激活调控;PH1、PH5表达均略晚于DRF基因的表达,可能是因为PH1、PH5表达需要花青素积累;PH1、PH5表达不影响花青素种类、数量及结构的变化,不影响细胞形状]。
矮牵牛在PH3调控下花冠呈红色,ph3突变体中,PH1、PH5表达减少,花冠表皮着色细胞液泡pH升高,颜色呈灰紫色。即使PH5过表达,也不足以使突变体表型恢复正常,但是当PH1也同时过表达时,ph3突变体可以恢复正常表型。这说明PH1、PH5形成复合体后,向花冠表皮着色细胞液泡泵入H+的能力成倍提高。PH5编码一个P3AATPase质子泵,该质子泵主要负责向花冠表皮着色液泡泵入H+。PH1编码的P3B-ATPase,缺乏阳离子结合与易位的关键——保守天冬氨酸残基,故不能行使质子泵功能,故液泡酸化过程中作为PH5的辅因子,与PH5形成杂聚肽复合物,共定位于花冠表皮着色液泡上,增强PH5转运H+的能力,实现液泡高酸化。PH1、PH5的同源基因广泛分布于被子植物中。
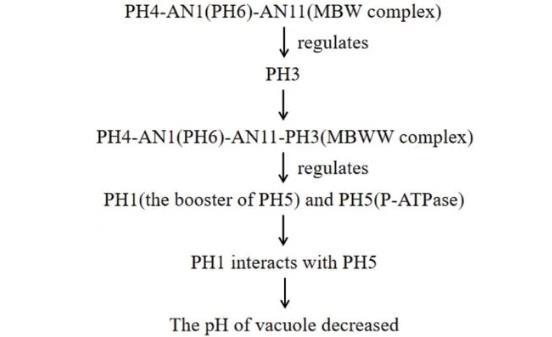
图2 PH基因编码蛋白调控液泡酸化可能的模式图
除控制液泡酸化之外,PH基因还在花青素合成通路、花器官着色细胞小型液泡类似物vacuolino与中央大液泡融合以及花器官发育等其它方面起着特殊作用。
PH1与膜蛋白运输有关。在矮牵牛花冠着色细胞与月季的花瓣表皮着色细胞中,发现了一类在花器官表皮着色细胞中存在、而在叶肉细胞中并不存在的液泡类似物vacuolino。复合质子泵PH1-PH5出现在vacuolino膜上,中央大液泡上的蛋白受体识别PH1后,二者形成链栓结构,相互融合,PH1-PH5进入之前无这两种蛋白的中央大液泡,这是一种膜蛋白运输方式的分支。矮牵牛突变体ph3和ph4中,vacuolinos无法产生;ph1突变体中vacuolinos与中央大液泡无法融合。
矮牵牛PH3基因与拟南芥TTG2基因高度同源且功能上可以互相代替,由于TTG2参与植株毛状物的形成以及原花青素积累和液泡酸化,因此PH3基因除了液泡酸化功能外,也参与植株毛状物的形成以及原花青素积累。
矮牵牛中纯合ph3会导致雌性不育,且会遏制F3′5′H基因的表达;花褪色显性等位基因Fa,只在ph3ph3和ph4ph4背景下表达;随着矮牵牛花冠的老化,变紫的背景下出现的红色斑点与扇区和ph7有关。
另外,PH基因还参与果实风味调控。从柑橘果实液囊中分离出CsPH5,CsPH5为PhPH5的同源基因,主要负责向果肉液囊中泵入氢离子,提高果实风味。但甜瓜中的PH基因编码的蛋白相似性最高的蛋白是PINs家族的蛋白,即H+/auxin泵,且该蛋白定位于内质网中,基因沉默后并未发生生长素缺失的表型。
对这两种调控植物花器官与果实器官酸度的不同基因家族的研究表明,不同植物、不同部位PH基因需要深入研究其功能与意义。