热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
冻害是造成巨大农业损失和植物死亡的主要因素,研究冷冻胁迫对植物的影响,对于揭示冻害机理,寻找抗冻害途径,减少因低温和冻害造成的农作物损失具有重要意义。目前,有关冷冻胁迫的研究主要集中在抗寒基因和基因表达产物、抗氧化防御系统、离子浓度变化和离子流、渗透调节物质等方面。研究表明,冷害会影响水稻细胞中抗氧化活性酶的活性,生成活性氧。]对鹰嘴豆苗进行冷冻处理,发现不饱和脂肪酸比率有所增加,CaCAT和CaSOD基因的转录水平升高,并生成大量的防御酶。对水稻进行低温处理后检测其根部细胞的钙离子(Ca2+)流,发现胞外的Ca2+会快速流入细胞内,COLD1基因超表达,水稻细胞对Ca2+的吸收极其强烈,表明COLD1可通过调控Ca2+来激活水稻的抗寒响应。
植物细胞中的Ca2+在抗逆境信号转导中一直备受人们关注。当细胞受低温、高温和盐碱等外部刺激时,早期的细胞信号事件几乎都是Ca2+的变化,影响了细胞内Ca2+水平平衡,形成钙信号被相应细胞器识别。现已有大量冷冻胁迫的研究数据证明,植物细胞内的Ca2+在感应、传导抗寒信号和诱导生理响应过程中起着重要的作用。当植物受冷冻胁迫时,Ca2+会流进植物细胞内,引起细胞内部Ca2+浓度升高,诱导植物细胞内抗寒基因的表达。Zheng等使用化学定位法研究了冷冻胁迫下枇杷叶肉细胞Ca2+分布的变化,发现冷冻胁迫首先会诱导Ca2+进入细胞内,并在叶绿体膜上聚集,最终进入叶绿体。van der Luit等对低温胁迫下的烟草幼苗进行了研究,发现低温会使细胞质和细胞核中Ca2+浓度快速升高,诱导NpCaM-1的表达。Mori等在拟南芥中发现低温会触发细胞内游离Ca2+浓度的迅速升高。目前的这些研究大多是检测组织、细胞或细胞器中Ca2+的分布、浓度变化和离子流来研究植物在受冷冻胁迫时的抗逆反应。但通过检测冷冻胁迫下原生质体破裂产生的Ca2+浓度信号来分析其细胞液中Ca2+分布的研究仍比较少。
在众多离子中,钠离子(Na+)的主要生理作用是增加细胞的渗透势。当植物吸收大量的Na+后,其胞内的电解质浓度增加,组成原生质体的胶体会发生膨胀,从而提高了原生质的亲水性,增加了细胞的保水力。低浓度的Na+对小麦、玉米、大豆、棉花和藻类等植物的生长都有促进作用。在1979年,Brownell和Crossland就已经证实,Na是C4植物的必需营养物质,如盐生植物滨藜和白刺,Na元素的缺失会导致叶片枯黄,生长延缓。而高浓度的Na+很容易对植物造成毒害,破坏细胞膜和使一些蛋白质不稳定,影响细胞的生理活动,如细胞分裂和生长、代谢及矿质营养元素的动态平衡等方面,抑制植物生长发育。目前对Na+的研究主要集中在植物盐害和抗盐性方面,但对冷冻胁迫下植物细胞中Na+分布的相关研究比较少。
近几年来,由于纳米技术的发展,纳米材料逐渐以各种方式渗透到人们的生产生活中。氧化锌纳米粒子(ZnO NPs)由于其独特的物理、化学特性被应用到陶瓷、纺织、医药、防晒化妆品和太阳能电池等方面。ZnO NPs可以通过水、土壤和空气等方式对人类、动物和植物造成影响。当前,有关ZnO NPs对动植物产生负面影响的报道比较多。如陈泽林等发现ZnO NPs对处于吸胀阶段、萌动阶段和发芽阶段的小麦都有毒性作用。Boonyanitipong等的研究表明,ZnO NPs可以阻碍水稻根生长,并减少根的数量。但还有研究表明,ZnO NPs在一定条件下,对植物的生长发育具有积极作用。Prasad等使用粒径为25 nm、浓度为1 000 mg·L-1的ZnO NPs处理花生种子,发现花生幼苗的萌芽和生存能力都得到了显著的提升。Pavani等报道称,ZnO NPs增加了鹰嘴豆新鲜和干燥的重量,促进了其芽、根的伸长。Abdel Latef等研究发现,ZnO NPs还可以减轻其他类型的非生物胁迫对植物所造成的影响。使用粒径为21.3 nm的不同浓度ZnO NPs(20、40和60 mg·L-1)浇灌盐渍土栽培(150 mmol·L-1NaCl)的羽扇豆,发现ZnO NPs不但促进了光合色素、酚类化合物和抗坏血酸的形成,还增强了超氧化物歧化酶、氧化氢酶和氧化物酶的活性。与未经ZnO NPs处理盐渍土栽培的羽扇豆相比,盐渍土抑制可其生长,减少叶绿素的色素沉淀,削弱过氧化氢酶的活性。但对于植物冷冻胁迫的研究,目前尚未有研究涉及ZnO NPs在植物受冷冻胁迫中的作用。
使用离子选择性微电极检测芦荟(Aloevera)原生质体破裂时形成的Ca2+浓度脉冲,同时检测Na+浓度作为对比,研究了冷冻胁迫对原生质体中Ca2+的分布的影响。并研究了冷冻温度、解冻时间和ZnO NPs处理等因素对冷冻胁迫下芦荟原生质体中离子的分布的影响。
1、材料与方法(Materials and methods)
1.1芦荟(Aloe vera)细胞原生质体的制备
使用分析天平(XS205DU,精度十万分之一,Switzerland)称取2.186 g甘露醇(≥80.5%,中国惠世生化试剂有限公司)、0.222 g二水合氯化钙(≥98%,西陇化工有限公司)、0.040 g磷酸二氢钾(≥99.5%,北京化工厂)、0.400 g纤维素酶(U·g-1>15 000,国药集团化学试剂有限公司)和0.280 g果胶酶(1.18 U·mg-1,Sigma Aldrich)放入烧杯中,加入20 mL去离子水,用磁力搅拌器(CL-2,巩义市予华仪器有限公司)搅拌。再将得到的溶液进行离心(DT5-6,北京现代北利离心机有限公司),转速2 000 r·min-1,时间8 min。取其上清液倒入烧杯中,酶解液制备完成。取长势优良的芦荟叶片,用去离子水洗净,把表面水分吸干,切成3 cm的小段,去除叶片表面透明表皮和中间透明胶质层后,切成4 mm宽的小条。取4 g左右的叶片,放入盛有20 mL酶解液的烧杯中,用封口膜将烧杯口封住。放入恒温培养振荡器(ZWYR-240,上海智诚分析仪器制造有限公司)中,黑暗条件下进行酶解,温度为20℃,转速为60 r·min-1,时间4 h左右。为促进酶解,每隔1 h摇瓶一次。
酶解后得到含有原生质体、维管成分和未酶解完全的叶子残片等的混合液,用200目的网筛过滤,得到初步纯化的芦荟原生质体,静止放置。为减少酶解液中含有的离子对后续测量的干扰,在测量前需用无钙、无钠培养基(浓度为109.3 mg·L-1的甘露醇溶液)清洗原生质体。用胶头滴管吸除原生质体上层的酶解液,向其加入20 mL无钙、无钠培养基,静置20 min。如此反复清洗4次,加入20 mL无钙、无钠培养基,室温下静止放置,备用。
1.2离子选择微电极的制备及表征
1.2.1离子微电极的制备
使用微电极拉制仪(WD-2,成都仪器厂)拉制玻璃微电极,设置加热指数为300,硼硅酸盐玻璃管(B150-110-10,外径1.5 mm,内径1.10 mm,长度10 cm,Sutter Instrument)经电阻圈加热软化,重锤下拉,得到微电极管。先将微电极管放置在温度为200℃的干燥箱中(DHG-9140A,巩义市予华仪器有限公司),进行预干燥处理1 h。再采取尾端注入法对微电极管进行硅烷化。然后在微电极管中灌充浓度为10-1mg·L-1的CaCl2或NaCl电解液,并在微电极尖端吸入液体离子交换剂。最后插入Ag/AgCl丝作为内参比电极,钙或钠离子选择性微电极制备完成。
1.2.2离子选择性微电极的表征
离子选择性微电极在使用之前需对其进行性能检测,从线性范围、检测下限、响应时间和稳定性4个方面对所制备的Ca2+、Na+选择性微电极进行了表征,如图1所示。

由图1(a)、(b)中可知,Ca2+、Na+选择性微电极在标定液浓度10-1~10-5mol·L-1范围内都有良好的响应,回归系数分别为0.9991、0.9996,检测下限均可达10-5mol·L-1。图1(c)为微电极在10-3mol·L-1的标定液中,连续检测3 h内的电位值,平均电位值分别为-(14.46±0.24)、-(52.44±0.59)mV,稳定性都良好。图1(d)为Ca2+、Na+选择性微电极在不同浓度标定液中的响应时间,分别为(0.550±0.016)、(0.646±0.014)s,都小于1 s,响应性能良好。以上情况说明,制得的Ca2+、Na+选择性微电极具有良好的性能,满足实验的要求。
1.3 ZnO NPs的表征及悬浮液的配制
1.3.1 ZnO NPs的表征
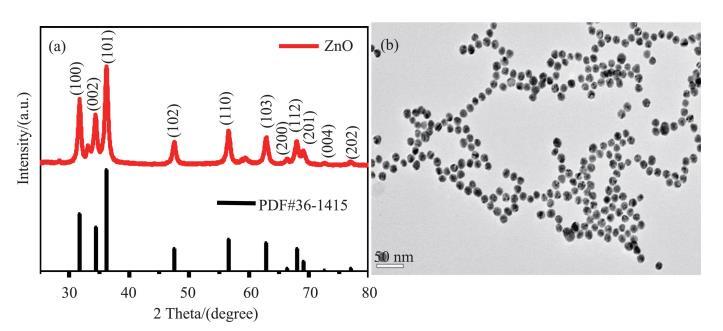
图2(a)、(b)分别为ZnO NPs(Sigma Aldrich)的XRD谱和TEM图。在图2(a)中,经与PDF#36-1415卡片对照后,发现测试谱中的所有衍射峰与标准谱完全一致,说明该物质为六角纤锌矿型ZnO,未见其他杂相存在。由图2(b)可以看出ZnO NPs形状呈球形,形貌均匀,平均直径约为20 nm。
1.3.2 ZnO NPs悬浮液的配制
用分析天平称取0.60、1.00、1.40和1.80 mg的ZnO NP放入烧杯中,分别加入20 mL无钙、无钠培养基。水浴超声(KQ-250DB,350 W,昆山市超声仪器有限公司)10 min,配制成浓度分别为30、50、70和90 mg·L-1的ZnO NP悬浮液。
1.4芦荟原生质体的冷冻处理
用胶头滴管吸除原生质体层上的培养基,摇晃烧杯,用移液枪吸取原生质体向6只培养管中各滴入1 000μL,注入5 mL的无钙、无钠培养基。其中1只室温下保存,5只放入冰箱冷冻处理,使其温度分别降至10℃、0℃、-5℃、-7℃和-10℃,取出后室温下静止放置,使已结冰的培养基完全解冻,温度恢复到室温待用。
1.5用ZnO NPs进行预处理和后处理
预处理:将芦荟原生质体随机分成约等量的4组,每组4份。取其中一组,分别注入5 mL不同浓度的ZnO NPs悬浮液(30、50、70和90 mg·L-1),放入冰箱冷冻处理,待温度降至-7℃后取出解冻,使其温度恢复到室温。
后处理:再取一组,分别滴入装有5 mL的无钙、无钠培基的培养管中,放入冰箱中冷冻结冰后取出。静止放置,待其温度恢复到室温时,去除上层培养基,注入不同浓度的ZnO NPs悬浮液(30、50、70和90 mg·L-1)各5 mL,处理20 min。
最后取剩余2组,分别加入5 mL的不同浓度ZnO NPs悬浮液,静止室温下分别处理3和18 h。
1.6离子脉冲信号的检测
为降低实验环境中可能存在的震动和电磁辐射对测量信号的干扰,实验需在金属屏蔽网中的防震台上进行。先将Ca2+、Na+选择性微电极和作为参比的甘汞电极分别固定在三维微操纵仪上,并与微电极放大器(SWF-1D,成都仪器厂)的前级相连(Ca2+、Na+选择性微电极分别接到不同的输入通道)。将样品池(10 mL无菌培养皿)放在倒置显微镜(CPX41,Olympus)的操作台上,将甘汞电极移到距样品池底部约0.5 cm处,缓慢将Ca2+、Na+选择性微电极靠近样品池底部并固定。将倒置显微镜调至4倍物镜,调节三维操纵仪使得2支选择性微电极在视野中央。再将物镜切换到10倍,细调三维微操纵仪使Ca2+、Na+选择性微下降至样品池底部,需保持2只微电极的尖端同时在视野中。最后用移液枪吸取50μL的待测原生质体,滴入装有10 mL低渗液(浓度为0.0273 mg·L-1的甘露醇溶液)的培养管中,轻轻摇晃均匀后缓慢倒入样品池中。保证甘汞电极和Ca2+、Na+选择性微电极同时浸没在溶液中。通过显微镜在视野中找到一个原生质体作为待测目标,并且视野中应没有其他原生质体存在。将Ca2+、Na+选择性微电极分别移动到目标原生质体附近,使2支选择性微电极的尖端尽量靠近该原生质体的同一位置。关闭屏蔽网,生理信号采集系统(RM6240B,成都仪器厂)开始记录并将信号显示在显示器上。观测到原生质体破裂的脉冲信号后,再等待电位恢复平稳停止记录,保存数据。
1.7统计学方法
每组实验重复3次,每次实验中从每组原生质体中随机选取3个原生质体(合计每组9个原生质体)进行离子浓度脉冲测试,用SPSS 22.0软件(SSPS Inc.)对实验数据进行方差分析。采用ANOVA方法对实验数据进行差异显著性分析(检验标准为P<0.05)。*表示P<0.05,**表示P<0.01。实验数据表述为平均值±标准偏差。