热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
2、结果与讨论
2.1、样品的物理表征
图1给出了Cu2O/Cu‐VG微电极的光学照片、表面和截面SEM、TEM图以及XRD图。该微电极的直径仅为200µm,具有半柔性特征,长度可控(图1a)。由低倍的表面SEM图观察到大量的石墨烯纳米片密堆积覆盖了整个Ta微丝表面(图1b和1c)。空白Ta微丝表面相对光滑,但能观察到预处理打磨留下的痕迹(图1d),而附着Cu前驱体的微丝的表面SEM图上观察到了主要依附于缝隙及裂痕上的异相颗粒(图1e)。然而,在Cu2O/Cu‐VG微电极的高倍SEM图则呈现纳米片相互交错包裹形成了开放的多孔、多缝隙形态(图1f),这显然有利于电解质的快速扩散。此外,从SEM截面形貌分析,石墨烯纳米片们直立于基底生长,该薄膜的高度达到了6µm左右,且高度相对均匀(图1g)。
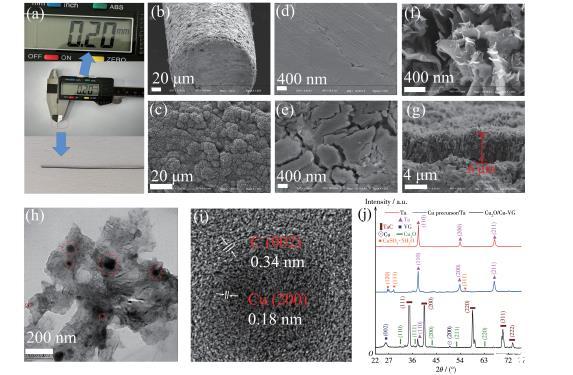
图1 Cu2O/Cu‐VG微电极的(a)光学照片及(b、c)表面SEM图;(d)Ta微丝、(e)Cu前驱体/Ta微丝及(f)Cu2O/Cu‐VG微电极的高倍表面SEM图;Cu2O/Cu‐VG微电极的(g)截面SEM及(h、i)TEM图;(j)3个微电极的XRD图
为进一步探索微结构,对该样品进行了TEM表征。如图1h所示,该样品的纳米片是一种半透明、可卷曲的二维片状晶体,但是表面镶嵌了大量的不同尺寸纳米颗粒。在制备TEM测试样的过程中对该样品进行了8 h的超声分散,但是这些纳米颗粒仍然牢固地镶嵌在二维纳米片上。一个纳米粒子的高分辨TEM分析表明,纳米粒子的表面被条纹间距为0.35 nm的石墨烯(002)晶面所覆盖(图1i),这与石墨烯的生长过程中同步还原Cu2O/Cu颗粒有关。为了进一步确认纳米颗粒的成分,对空白Ta微丝、Cu前驱体/Ta微丝及Cu2O/Cu‐VG微电极进行了XRD分析,结果如图1j所示。
与空白Ta微丝相比,从Cu前驱体/Ta微丝的XRD图中观察到了CuSO4的(120)、(111)、(311)晶面衍射峰,分别位于25.5°、27.0°、57.0°附近。这表明先浸泡再红外干燥的工艺把CuSO4晶体成功附着到了Ta微丝上。此外,Cu2O/Cu‐VG微电极的XRD图显示了TaC、Cu、Cu2O以及石墨相关的衍射峰,其中TaC特征峰(PDF No.35‐0801)来自Ta微丝表面的碳化过渡层。在26.0°附近出现了石墨烯的(002)晶面衍射峰(PDF No.41‐1487),而49.9°附近的是Cu(200)晶面特征峰(PDFNo.89‐2838)。此外,还观察到了相对弱的Cu2O相的(110)、(111)、(200)、(211)和(220)晶面衍射峰(PDFNo.78‐2076)。这些结果证实成功制备了Cu2O/Cu‐VG微电极,而Cu2O/Cu‐VG薄膜则利用TaC过渡层牢固结合在Ta微丝表面。
2.2、微电极的阻抗及电化学反应动力学行为
为了研究Cu2O/Cu‐VG微电极的电化学和生理电双模性能,先分析了Ta、Cu2O/Cu、VG及Cu2O/Cu‐VG微电极在电化学反应动力学研究中常用的5.0mmol·L-1 K3[Fe(CN)6]/K4[Fe(CN)6]混合溶液中的反应动力学特性,并进一步探讨了这些微电极在手背皮肤以及受脑电影响的头皮区域的阻抗特征(图2)。对于Nyquist图,高频区与实轴的交点为半电池体系的总内阻(Rs),高频区的半圆直径与电极、电解质之间的界面电荷转移电阻(Rct)有关,半圆直径越大,表明Rct值越大,而低频区的直线段反映了离子的扩散效应。在[Fe(CN)6]3-/[Fe(CN)6]4-探针溶液里,Rs为8.26~9.36Ω。此外,Ta微丝表现了金属电阻特性,Cu2O/Cu微电极则呈现金属局部腐蚀电极特性(图2a);而在VG和Cu2O/Cu‐VG微电极的阻抗谱上观察到了半无限扩散特征(图2b)。如图2c和2d所示,Cu2O/Cu‐VG微电极的Rct最低,该值为23.74Ω,表示在液-固界面可以快速传输电子,这与扩散传质有关。4种微电极在手背上均表现了扩散传质特性,但阻抗大幅增加了(图2e和2f)。
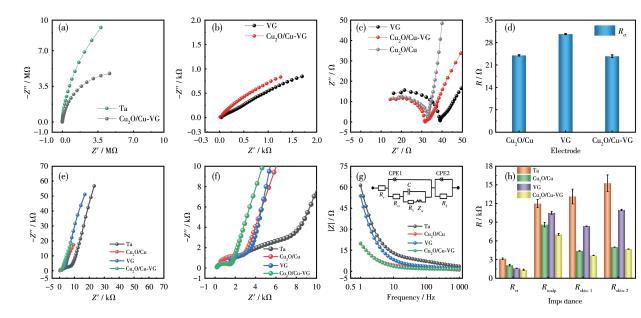
图2微电极的阻抗分析:(a~c)在5.0 mmol·L-1 K3[Fe(CN)6]/K4[Fe(CN)6]溶液里记录的Nyquist图、(d)液-固界面Rct、(e、f)手部Nyquist图、(g)手部的频谱-阻抗谱(插图:4种微电极的等效电路图)和(h)Rct、Rscalp、Rskin,1和Rskin,2
Rct值从大到小的顺序为Ta>Cu2O/Cu>VG>Cu2O/Cu‐VG,其中Cu2O/Cu‐VG微电极的Rct值达到1.36 kΩ,这与皮肤角质层的阻抗显著高于[Fe(CN)6]3-/[Fe(CN)6]4-电解液有关。图2g显示了手背上记录的频率-阻抗谱。如图2h所示,在4种微电极中,Cu2O/Cu‐VG微电极具有最低的皮肤接触阻抗,其中包括α节律范围(8~13 Hz)的皮肤阻抗值(Rskin,1)为3.65 kΩ,生理电范围(1~1 000Hz)的皮肤阻抗值(Rskin,2)为4.67 kΩ。我们继续监测了头皮接触电阻(Rscalp),Cu2O/Cu‐VG微电极仍然具有最低值,该实时值约为7.05 kΩ,远低于表皮可用电阻50 kΩ。
这些结果表明,Cu2O/Cu‐VG微电极作为电化学传感电极具有低的Rct值,可以提高电解质和电极之间的电子转移过程,又可作为表皮电极直接从头皮记录生理电信号。此外,使用Ta、Cu2O/Cu、VG及Cu2O/Cu‐VG微电极记录了10µmol·L-1尿酸溶液的DPV曲线。如图3a所示,Ta微丝不响应尿酸,Cu2O/Cu微电极上观察到了微弱的氧化峰;而在VG微电极上出现了明显的尿酸氧化峰,峰电位在0.232 V。当使用Cu2O/Cu‐VG微电极时,尿酸的氧化峰电位轻微移动到0.244V,但其峰电流达到了VG微电极上的6倍。这表明Cu2O/Cu纳米颗粒和石墨烯协同提高了尿酸的响应信号。接着,使用Cu2O/Cu‐VG微电极,把0.1 mol·L-1KCl、5.0 mmol·L-1 K3[Fe(CN)6]和5.0 mmol·L-1K4[Fe(CN)6]的混合溶液作为电解液,以10~1000 mV·s-1的电位扫描速率记录一组CV曲线,分析了电化学反应动力学行为的相关参数。图3b呈现的CV曲线中出现了2对氧化还原峰,在0.13~0.25 V处的一对峰对应于[Fe(CN)6]3-/[Fe(CN)6]4-氧化还原探针,在0.6~0.7 V处的一对峰对应于KCu[Fe(CN)6]/K2Cu[Fe(CN)6]的氧化还原反应过程。

图3(a)四种微电极对10µmol·L-1尿酸的DPV曲线(插图:Ta和Cu2O/Cu微电极响应曲线局部放大图);Cu2O/Cu‐VG微电极的(b)以10~1 000 mV·s-1的扫描速率记录的CV曲线、(c)峰电位和扫描速率对数的关系、(d)峰电流与扫描速率平方根的线性关系
进一步利用[Fe(CN)6]3-/[Fe(CN)6]4-氧化还原探针峰,建立了峰电位(Ep)和扫描速率对数(lg v)、峰电流(Ip)和扫描速率平方根(v1/2)之间的线性关系(图3c和3d)。Ip与v1/2之间的线性关系证实了该电极表面扩散控制的电化学反应动力学行为。根据Randles‐Sevcik方程(Ip=2.69×105An3/2D01/2v1/2c0),利用已知扩散系数D0=7.6×10-6 cm2·s-1、氧化还原电对的初始浓度c0=5 mmol·L-1、电子转换数n=1、以及v1/2和峰电流Ip之间的斜率值,得到电极的有效活性面积(A,0.20 cm2)是几何面积(0.06 cm2)的3.3倍。利用Laviron理论方程求得的反应速率常数(ks)为0.82 s-1。这些结果表明了该微电极具有优异的电催化能力。
2.3、微电极的生理电响应性能
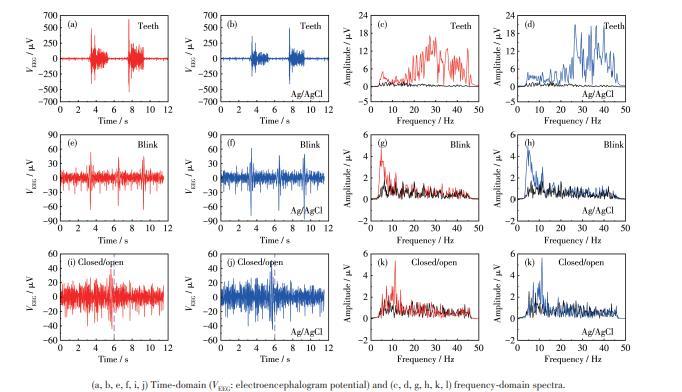
图4使用Cu2O/Cu‐VG微电极(红)和商用Ag/AgCl电极(蓝)同步记录的肌电、眼电及脑电信号的时域谱和频域谱:(a~d)咬牙范式下记录的肌电信号、(e~h)眨眼范式下记录的眼电信号、(i~l)闭眼/睁眼范式记录的脑电信号
图4为使用Cu2O/Cu‐VG微电极和商用Ag/AgCl电极同步记录的肌电、眼电、脑电信号(随附视频见Supporting information)。红色谱线表示使用Cu2O/Cu‐VG微电极采集的信号,蓝色谱线表示使用Ag/AgCl电极采集的信号。对比咬牙范式的肌电(图4a~4d)、眨眼范式的眼电(图4e~4h)以及闭眼/睁眼范式的脑电信号(图4i~4l),从时域谱和频域谱可观察到,Cu2O/Cu‐VG微电极与商用Ag/AgCl电极具有接近的幅值、生理电频率特征、以及脑电α节律特征范围,且与正常人的生理电表现形式吻合。图5a和5b选取了随附视频中眨眼、咬牙范式记录脑电的实际场景,而图5c和5d给出了进一步计算的Cu2O/Cu‐VG微电极和商用Ag/AgCl电极的生理电信号之间的相关度以及2种电极的信噪比(SNR)值。结果表明,2种电极的信号相关度在99%以上,Cu2O/Cu‐VG微电极的平均SNR值高于商用湿电极,这证实了Cu2O/Cu‐VG的高效脑电采集能力。
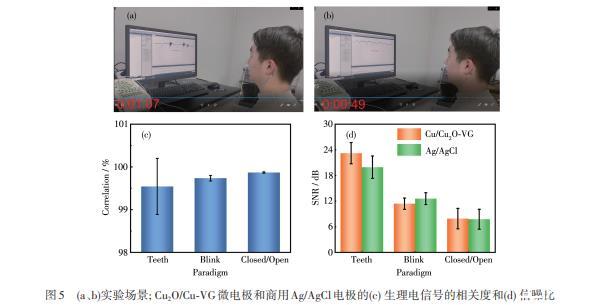
图5(a、b)实验场景;Cu2O/Cu‐VG微电极和商用Ag/AgCl电极的(c)生理电信号的相关度和(d)信噪比
2.4、微电极的尿酸检测性能
使用Cu2O/Cu‐VG微电极以DPV法定量检测了尿酸。考虑到生物液体的pH值对峰电流的影响,最先评估了pH 6.0~8.0范围的尿酸响应能力。如图6a~6e所示,随着尿酸浓度的提高,氧化峰电流随之提高,表明Cu2O/Cu‐VG微电极在该pH范围内均能定量响应尿酸。此外,尿酸的峰电位随pH的增加而负向偏移,而且pH与氧化峰电位之间存在线性关系,对应的线性回归方程为Ep=0.764-0.070pH。该斜率0.070 V近似于理论值0.059 V,表明在电极反应转移的质子和电子的数目相同(图6f)。在该Cu2O/Cu‐VG微电极上尿酸的可能电化学
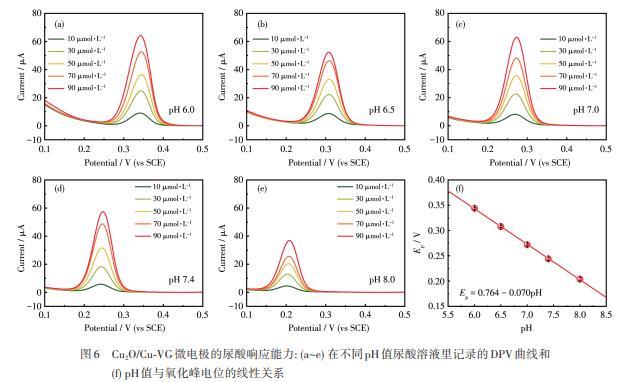
图6 Cu2O/Cu‐VG微电极的尿酸响应能力:(a~e)在不同pH值尿酸溶液里记录的DPV曲线和(f)pH值与氧化峰电位的线性关系
反应见式1:

(1)图7给出了在不同pH值环境中Cu2O/Cu‐VG微电极对尿酸响应的工作曲线及灵敏度。对于10~90µmol·L-1的尿酸,峰电流与尿酸浓度均呈线性关系。此外,在pH 6.0~8.0范围内,随着pH值的升高,尿酸的灵敏度先升高后降低,灵敏度变化范围为0.428~0.797µA·L·µmol-1。这些结果证实了该Cu2O/Cu‐VG微电极适用于脑脊液、血液、尿液、肠液等不同pH值的体液环境。进一步模拟pH 7.4的体液环境,详细考察了Cu2O/Cu‐VG微电极对尿酸的定量检测能力。图8a展示了使用该微电极在0.5~500µmol·L-1的浓度范围内记录的DPV曲线,而图8b给出了工作曲线。
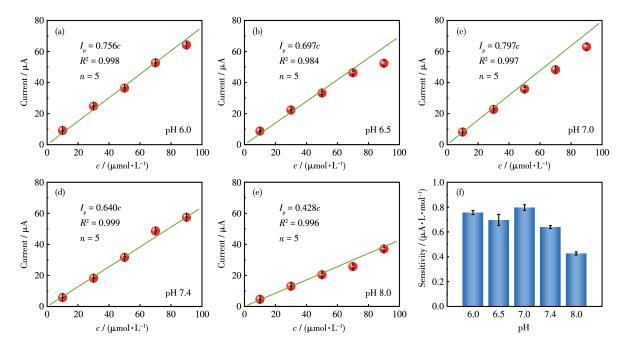
图7 pH值对尿酸响应的影响:(a~e)尿酸浓度和峰电流的线性关系、(f)尿酸灵敏度
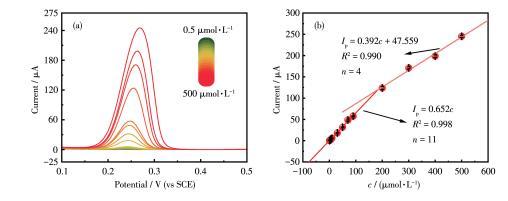
图8使用Cu2O/Cu‐VG微电极检测尿酸的定量模型:(a)在pH 7.4的尿酸标准溶液里记录的DPV曲线、(b)工作曲线及定量方程
在该浓度范围内存在2个线性区域,对于0.5~200µmol·L-1的尿酸,线性回归方程为Ip=0.652c,其中Ip代表尿酸响应的峰电流,c表示尿酸的浓度,R2=0.998;对于200~500µmol·L-1的尿酸,线性回归方程为Ip=0.392c+47.559,R2=0.990。该Cu2O/Cu‐VG微电极检测尿酸的线性浓度范围达到0.5~500µmol·L-1,涵盖了脑脊液、血液、尿液的正常人群检测范围,而LOD低至0.024µmol·L-1,还可用于其它低尿酸水平标本的原位检测。为了评价Cu2O/Cu‐VG微电极的尿酸选择性,在10µmol·L-1尿酸溶液里加入了体液中可能共存的各种有机和无机化合物,分别记录了存在干扰物和不存在干扰物时尿酸溶液的DPV曲线(图9a)。
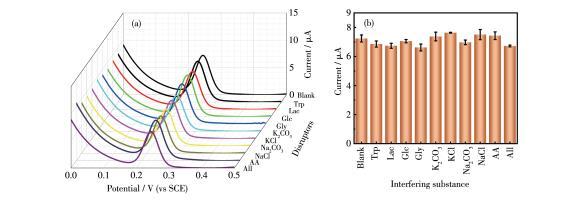
图9以10µmol·L-1尿酸为模型的抗干扰能力:(a)尿酸与不同干扰物共存时的DPV曲线、(b)不同干扰物对尿酸峰电流的影响
作为干扰的化合物包括色氨酸(Trp)、乳糖(Lac)、葡萄糖(Glc)、甘氨酸(Gly)、K2CO3、KCl、Na2CO3、NaCl、抗坏血酸(AA)、以及混合的干扰物。这些化合物的浓度均为10µmol·L-1,与尿酸浓度相同。这些干扰物对尿酸响应电流的改变量范围为1.82%~8.59%,其中Gly(8.59%)干扰相对大,总的相对标准偏差(RSD)为8.59%,在可接受的范围之内,证实了Cu2O/Cu‐VG微电极对尿酸具有良好的选择性。
为了更接近实际应用,对于一个Cu2O/Cu‐VG微电极研究了长达3个月的长期稳定性。图10a展示了不同日期记录的DPV曲线,检测对象是10µmol·L-1的尿酸。图10b给出了峰电流的统计结果。如图所示,3个月内尿酸的峰电流保持在7.23~8.29µA范围内,RSD为4.70%;而3个月后峰电流达到了初始值的97.26%。这些结果证实了Cu2O/Cu‐VG微电极具有良好的长期稳定性。
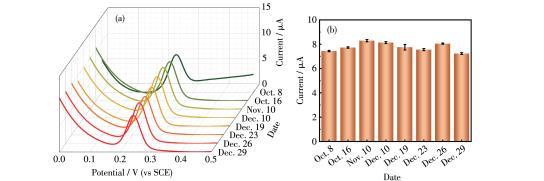
图10以10µmol·L-1尿酸为模型的长期稳定性:(a)不同日期记录的DPV曲线、(b)氧化峰的峰电流
3、结论
通过一步直流电弧等离子体喷射CVD法同步还原铜催化剂并垂直生长多层石墨烯,制备了一种Cu2O/Cu‐VG微电极,把Cu2O/Cu纳米颗粒牢固镶嵌到了多层石墨烯纳米片上。首先,Cu2O/Cu的掺杂保持了石墨烯的生长取向及二维纳米晶体特性,增加了石墨烯的电催化活性位点,有效电活性面积达到了几何面积的约3.3倍,液-固界面电荷转移电阻仅为23.74Ω,具有高的电催化活性。其次,Cu2O/Cu‐VG微电极的头皮接触电阻低至7.05 kΩ,在头皮和脑机接口之间建立了有效的非接触电容式界面,肌电和脑电信号的SNR值分别达到23.2和7.9 dB,优于商用Ag/AgCl电极。此外,Cu2O/Cu‐VG微电极可以快速、灵敏地电化学响应尿酸,定量响应的pH范围达到6.0~8.0,在pH 7.4的环境中LOD低至0.024µmol·L-1,而且具有优异的选择性及长期稳定性。本工作提出的Cu2O/Cu‐VG微电极可以原位同步检测尿酸浓度和脑电信号,为体内尿酸水平、脑电及脑功能关联机制研究提供了一种有潜力的可植入双模微电极。