热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
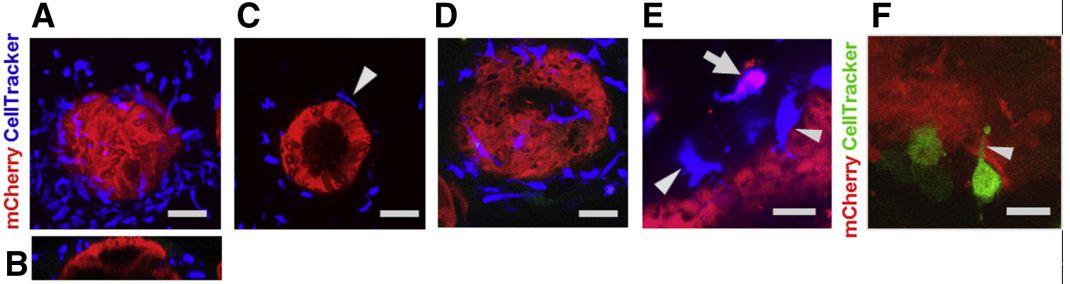
图2、MoDCs直接与共培养的胃球上皮细胞结合。将细胞追踪器标记的MoDCs加入表达mCherry的胃球形细胞培养物中。48小时后,在Leica SP5激光共聚焦扫描显微镜上使用63×水浸物镜对培养物进行固定和成像。(A-C)迁移到胃上皮球体(红色)基外侧的细胞追踪DeepRed标记MoDCs(蓝色)。比例尺:50μm。(A)XY图像,57个单独图像的最大Z投影,步长为1μm。(B)同一球体的XZ投影。(C)单张XY切片显示了直流电(箭头)与球面之间的物理联系。(D)6个相邻切片的Z向投影显示胃球表面广泛的树突形成。(E)高分辨率图像显示,CellTracker DeepRed标记的MoDCs(蓝色)与胃上皮细胞(箭头)直接接触,1个MoDC内含mCherry+胃上皮细胞物质(合并图像中为粉红色;箭头)。(F)细胞追踪绿标记的MoDC(绿色)将树突(箭头)延伸至上皮细胞层(红色)。
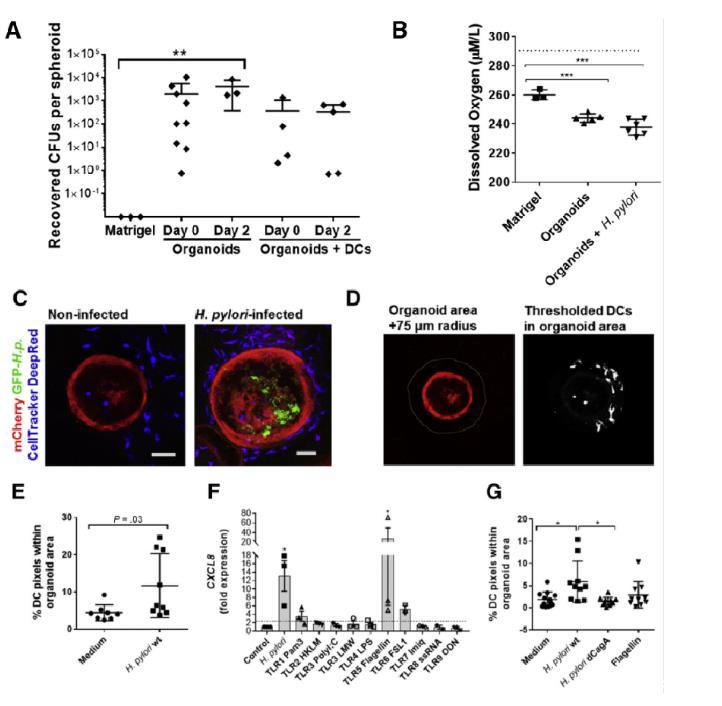
图3、幽门螺杆菌感染人胃上皮细胞球导致DC募集增加。(A)从单独的Matrigel或幽门螺杆菌感染的胃球形培养物(20-50个/培养物)(有或没有共培养的MoDCs)中回收细菌。(B)微电极分析胃球体内测得的管腔氧浓度(n=5或6个有机体,均数±标准差)。虚线表示缓冲液中的氧气浓度。(C)未感染和感染GFP-幽门螺杆菌(绿色)、表达mCherry的胃球形体(红色)与CellTracker标记的MoDCs(蓝色)共培养48小时的代表性共聚焦图像(单个光学切片)。(E)对3个独立实验中8个未感染和9个感染了GFP-幽门螺杆菌的球状体共培养物的数字图像分析。图中显示了单个数据点的平均值±SD。(F)将胃上皮球形细胞复制为单层细胞,并用幽门螺杆菌60190野生型(wt,5×107个/孔)或一系列TLR激动剂(见“材料与方法”部分)处理6小时。(G)胃球体微注射单独的FITC右旋糖酐(分子量4千道尔顿,示踪剂)或含有幽门螺杆菌60190野生型、幽门螺杆菌60190ΔCagA或沙门氏菌鞭毛蛋白(1μg/ml)的FITC右旋糖酐。
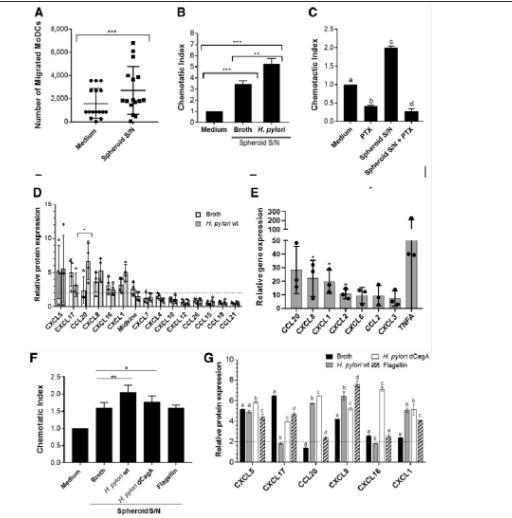
图4、幽门螺杆菌感染会增加人胃上皮细胞趋化因子的表达,导致直流电募集增强。(A)在Transwell趋化试验中,检测从已建立的球形培养物中收集48小时以上的培养上清(S/Ns)吸引MoDCs(2×105个/孔)的能力。(B)从感染或未感染幽门螺杆菌的胃小球中收集的培养上清液在小球显微注射48小时后与MoDCs(1×105个/孔)一起在Transwell趋化试验中进行分析。(C)分析了MoDC在存在或不存在百日咳毒素(PTX,10μg/mL)的情况下对单独培养基或胃球上清的趋化性。图中显示的是一式三孔的平均值±SD,3个实验中有1个具有代表性。(D)利用趋化因子阵列分析从感染幽门螺杆菌和未感染幽门螺杆菌(48小时)的球形培养物中收集的上清液中是否存在趋化因子。(E)幽门螺杆菌感染球体与非感染球体中部分趋化因子和细胞因子基因的相对基因表达。(F)48小时后,收集胃球微注射肉汤、幽门螺杆菌野生型(wt)、幽门螺杆菌ΔCagA或沙门氏菌鞭毛蛋白的培养上清。(G)用趋化因子阵列分析不同处理的球形培养物上清液中是否存在趋化因子。
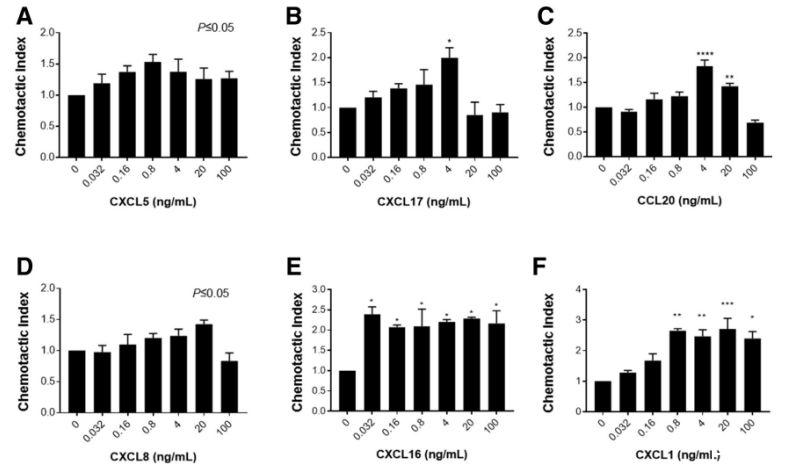
图5、MoDCs对胃上皮释放的多种趋化因子具有趋化活性。Transwell趋化试验分析了MoDCs对不同浓度的(A)CXCL5、(B)CXCL17、(C)CCL20、(D)CXCL8、(E)CXCL16和(F)CXCL1的趋化活性。图中显示了3个或更多实验的代表性结果。一式三孔的平均值±SD,采用单因素方差分析。
结论与展望
本研究通过新型胃球共培养模型揭示了胃上皮细胞在幽门螺杆菌感染下通过趋化因子依赖性机制主动募集树突状细胞的现象。这一发现不仅为理解胃黏膜免疫反应提供了新的视角,还为开发针对幽门螺杆菌感染的新型免疫治疗策略提供了理论基础。研究结果强调了胃上皮细胞在免疫监视中的重要作用,并为研究其他胃肠道病原体与宿主免疫系统的相互作用提供了新的思路。本研究的创新之处在于开发了一种能够模拟胃黏膜生理环境的共培养模型,该模型不仅允许免疫细胞与胃上皮细胞的直接相互作用,还能够支持幽门螺杆菌的长期感染。这一模型为研究胃黏膜免疫反应提供了新的工具,并为理解幽门螺杆菌感染的免疫机制提供了新的视角。研究结果表明,胃上皮细胞在稳态和感染状态下均能够通过分泌趋化因子主动募集DCs,这一过程在幽门螺杆菌感染时显著增强。这些发现为开发针对幽门螺杆菌感染的新型免疫治疗策略提供了理论基础,并为研究其他胃肠道病原体与宿主免疫系统的相互作用提供了参考。
unisense微电极通过精确测量胃球体内的氧浓度,帮助研究人员模拟了幽门螺杆菌的生长环境,验证了胃球体模型的生理相关性,并为实验设计提供了重要依据。通过Unisense微电极测量数据,研究人员发现胃球体内的腔隙氧浓度显著低于周围环境(如Matrigel基质),这种低氧环境可能有助于幽门螺杆菌的生存和繁殖。这一发现解释了为什么幽门螺杆菌能够在胃球体内部持续存活,而直接注入Matrigel中的细菌则无法存活。这一技术的应用不仅增强了研究的科学性和准确性,还为理解幽门螺杆菌感染的机制提供了新的视角。