热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
1、引言
脑是生命体中精密又复杂的系统,通常神经元的集体行为会产生大脑功能的变化,神经元之间信息的传递本质上是神经递质在神经元突触间的传递。了解神经元所处的微化学环境以及信息传递中的分子机制对深刻理解大脑功能具有十分重要的意义;对许多中枢神经系统(CNS)疾病,如多发性硬化(MS)、阿兹海默症(AD)和癫痫的治疗及预防具有重要指导意义。神经化学物质主要包括:神经元信息传递中起着重要作用的递质,如单胺类递质(多巴胺、去甲肾上腺素、肾上腺素等),氨基酸类递质(谷氨酸、氨基丁酸等),神经调质(抗坏血酸等),离子(H+、K+、Zn2+、Ca2+、Mg2+等),活性氧自由基(H2O2、O2等),能量代谢物质(葡萄糖、ATP等),氨基酸,脂质,多肽,磷脂,蛋白质,核酸(DNA和RNA)和参与神经活动的其它的化学物质(乙酰胆碱、神经肽等)。因此,实时监测脑内神经化学物质的动态变化,对于更好地认识与脑相关的生理及病理学过程具有重要的意义。
活体原位电化学分析方法是将微电极植入特定脑区原位监测神经化学物质动态变化的方法,该方法因具有高时空分辨率、高灵敏度和对脑组织损伤小等优势,受到越来越多的关注。但脑环境较为复杂,不仅存在许多小分子物质,而且还包含许多生物大分子。当微电极植入到脑组织时,生物大分子(特别是蛋白质)会迅速地吸附在微电极表面(此过程被认为是生物污染的第一步)。吸附的蛋白质会覆盖电极表面部分活性位点,阻止物质传输和电子(电荷)转移,最终导致微电极的灵敏度和选择性降低。此外,微电极将不可避免地导致一系列不良的生物反应,如细胞黏附、血小板活化、血栓形成以及补体激活。这些过程将会导致电极周围化学环境的改变,从而影响微电极对神经化学物质检测的准确性。此外,形成的纤维囊会完全阻碍电极表面上的电子转移和物质传输,从而导致微电极无法正常工作(图1)。因此,抑制蛋白质的非特异性吸附在一定程度上可防止电极表面生物污染。
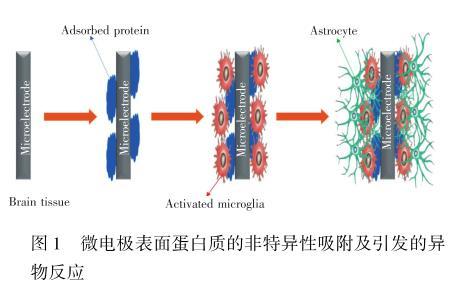
本文将简单地介绍蛋白质吸附对电极性能的影响,及电化学中抗蛋白质吸附的方法策略,并详细综述活体原位电化学分析中抗蛋白质吸附研究的进展。
2、蛋白质吸附对电化学性能的影响
在电化学传感器的研究中,不仅需要研究蛋白质在电极表面的非特异性吸附,最重要的是研究蛋白质吸附对电极电化学性能的影响。一般认为吸附在电极表面的蛋白质层是一个惰性的、非电化学活性的阻碍层,会影响电极的电化学性能,如法拉第电流、双电层电容(Cd1)、电极阻抗,从而影响电极对待测物的电化学检测结果,而且,这种影响随着电极表面蛋白质的覆盖率增大而加剧,影响最大的是电极的法拉第电流。因在任何情况下,电极表面发生蛋白质的非特异性吸附时,电极表面和电解质之间的电子(电荷)转移速率都会受到严重阻碍,探针(或待测物)扩散到电极表面发生氧化还原反应也会被阻碍或完全阻止。
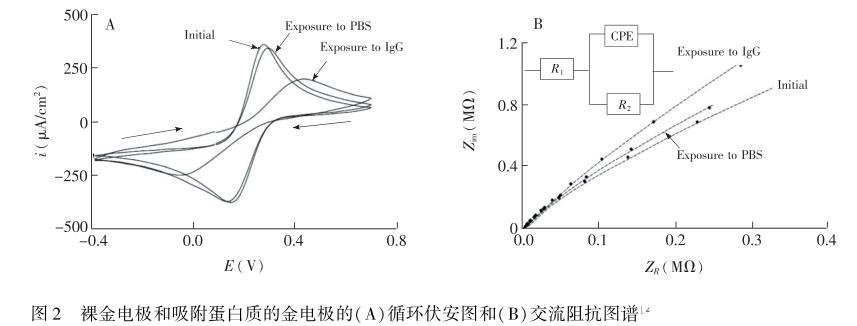
蛋白质吸附会影响电极/电解质界面处靠近电极表面紧密层的结构,从而导致电极双电层结构(双电层电容)的改变。研究表明:将电极暴露于蛋白質溶液中,会导致电极/电解质界面处的电子(电荷)转移电阻(Rct)增加以及电极的Cd1减小。Rct的增加将会导致探针(或待测物)的氧化/还原电位分别正移或者负移(ΔEp增加)。此外,Cd1的改变受到各种检测条件的影响,例如,当吸附发生在电极开路电位或更高电位时,电极的最大电容更大程度的减小;在相同条件下,与吸附的血清白蛋白相比,免疫球蛋白G(Ig.G)的吸附会导致Cd1减小的更多(图2)。也有研究表明,吸附的蛋白质导致电极Cd1的变化通常约为裸电极的10%,一般电化学检测技术(如计时电流法或微分脉冲伏安法)可不考虑,因已经扣除了背景充电电流,或者充电电流相对于法拉第电流衰减的较快。