热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
活体伏安法是将微电极直接插入大脑特定部位,实现脑内生理活性物质的活体实时分析的电化学分析方法。因其所用微电极尺寸小,可置入脑组织,分析时空分辨率高,活体伏安法在脑神经化学过程的研究中备受关注。
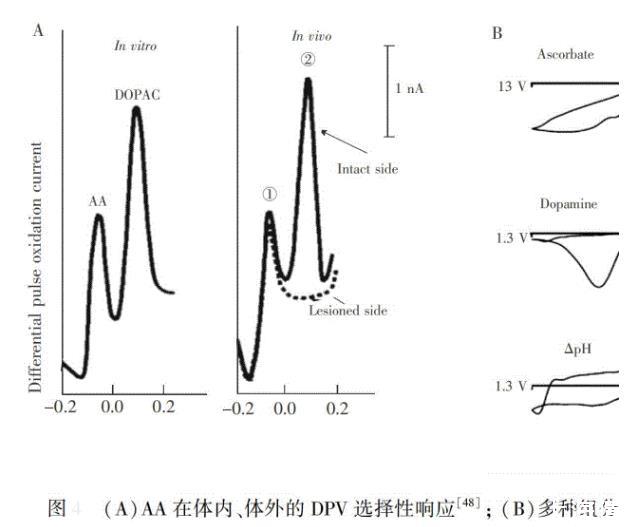
Adams等于1972年第一次将碳糊电极(直径约300μm)植入大鼠脑内,并获得了脑内第一张循环伏安图,并猜测所获得的伏安信号为AA的氧化峰。用同样的方法,O'Neill等通过脑区微注射和腹腔注射AA,增加了伏安信号,Brazell等通过向脑区注射AA选择性氧化酶(Ascorbate oxidase,AAOx),证实了获得的伏安信号为AA,并用该方法测定了不同脑区和微注射谷氨酸时AA的变化。然而,碳糊电极直径太大,碳纤维电极(CFE,5~7μm)具有较高空间分辨率和生物兼容性等性能,因此,越来越多研究开始关注CFE,并发展了许多检测AA的方法。Gonon等第一次对CFE进行处理,用DPV法实现了脑内AA的选择性分析。Heien等通过快速扫描循环伏安法(Fast scan cyclic voltammetry,FSCV)和主成分回归分析对FSCV数据进行了多组分分析,可同时测定AA、5 HT、DA、DOPAC、pH值的实时变化(。
如前所述,对电极表面进行合理的功能化,是实现AA选择性分析的有效策略。第一次在电极表面修饰CNT,实现了AA的活体检测。AA在CNT修饰的CFE上在0.0 V左右达到稳态电流,说明修饰在CFE上的CNT对AA具有很好的电化学催化作用。此外,DA、尿酸和5 HT这些脑内神经化学物质的氧化电位都比AA在CNT修饰的CFE氧化电位正,因此不干扰AA的电化学分析。他们通过多壁碳纳米管(Multiwalled carbon nanotube,MWNT)修饰的CFE,用DPV的方法检测鼠脑细胞间液中AA的浓度约为(0.20±0.05)mmol/L。他们通过向电极附近注入AAOx,证明MWNT修饰的CFE电极对AA具有很好的选择性。
由于CNT修饰CFE的技术在神经科研领域的研究较难,且电极制备的可重复性有待进一步提高,Xiang等制备了阵列碳纳米管覆盖的碳纤维微电极(Vertically aligned carbon nanotube sheathed carbon fiber,VACNT CFE),大大简化了碳纳米管微电极的制备方法,避免了手工滴涂修饰CNT引起的电极性能差异,以及繁杂修饰步骤。CFE(A)和VACNT CFE(B)的扫描电镜图,CNT均匀生长在CFE表面,在稀H2SO4溶液中电化学预处理,得到的VACNT CFE对AA的响应与裸CFE相似,然而,VACNT CFE在NaOH溶液中电化学活化后,表现出对AA良好的电催化性能,降低了AA氧化的过电位,并增大了其电流响应,这些实验结果证明了CNT的端口碳对AA具有良好的催化性能。VACNT CFE对AA的分析呈现出良好的选择性和线性关系,并可观察到灌注谷氨酸所引起的AA释放,实时监测了AA和谷氨酸的异相交换行为。
在CFE表面垂直生长CNT方法可用于脑内AA测定,虽然该电极制备方法可避免人工修饰引起的一系列问题,但是该方法复杂,不利于大量制备电极。为进一步简化CNT电极的制备,Xiao等发展了一种可控且重现性极高的电泳沉积SWNT修饰电极的方法,电泳的方法可非常简单地将酸化处理的SWNT沉积到CFE表面,该电极对AA的电化学氧化表现出良好的催化作用,重现性高。
重要的是,检测AA时,CNT修饰的CFE比电化学处理的CFE具有更好的稳定性,因此有利于研究脑科学与AA相关的生理或者病理过程中AA变化。如扩散性抑制(Spreading depression,SD)是一种在脑内神经细胞去极化,随后受到抑制并类似去极化波在神经及胶质细胞间进行传播的现象。SD发病过程与偏头痛、癫痫发病过程非常相似。因此SD发病过程中机理的研究,对于相关疾病的发病机制的研究和治疗都有重要的参考意义。Xiao等用SWNT修饰的CFE测定了鼠脑皮层由电刺激引发的SD过程中AA的浓度动态变化。利用给予局部注射AAOx和改变施加电位的方式,进一步验证记录到的电流的变化是由SD导致胞外AA浓度变化引起的。为进一步理解SD过程中AA释放的机理,局部注射NMDA受体拮抗剂地佐环平(MK 801)阻断谷氨酸依赖的SD的传播,并可抑制SD过程中AA的释放,进一步证明了AA的释放受SD过程中谷氨酸的调节。为了探索AA的释放是否是由于谷氨酸异相交换引起的,采用D,L苏式β苄氧基天冬氨酸(D,L TBOA)进行干预,大鼠给予D,L TBOA后,发现电刺激AA的释放并未被抑制。因此,报道认为SD过程中AA释放并不是谷氨酸的异相交换引起的,可能与SD过程中细胞水肿密切相关。
比率型电分析引入内参比氧化还原电对,使用待分析物和内参比的电流响应对分析物进行分析,可克服复杂体系的基底效应。Tian研究组首次提出比率型电分析策略,并将CNT纺成碳纤维丝,制备得到CNT纤维(Carbon nanotube fiber,CNF),实现了活体内比率型AA的分析检测。AA在CNF上的氧化电位为50 mV,利用DPV技术,结合比率型电化学方法,对脑内的AA实现了选择性分析,采用该方法观察到到老年痴呆症大鼠皮层、纹状体和海马3个脑区AA含量明显低于正常大鼠。将硫瑾固定在炭黑修饰的CFE上,结合比率型电化学,用循环伏安法选择性检测听皮层的AA,并观察到水杨酸钠引起的耳鸣过程中AA的变化。
同时记录神经元的电活动信息以及脑内AA的动态变化可将神经细胞之间的信号传递与AA密切相关的神经调节过程联系起来,从而深入理解脑生理和病理过程的信号转导机制。Cheng等将SWNT修饰的CFE和毛细管玻璃微电极有效集成为双通道微电极(Integrated dual mode microelectrode,IDMME),用CFE选择性记录AA,用玻璃管微电极记录电生理信号,该双通道微电极可独立记录化学和电信号,两种信号之间没有交叉干扰,并成功地用于原位连续监测大鼠脑缺血/再灌注过程中AA以及神经元细胞电活动的动态变化。
生物大分子在电极表面的吸附是活体原位分析AA面临的另一个挑战,因为脑内环境较复杂,不仅存在许多小分子干扰物质,还包含许多生物大分子(如脂质,蛋白质)。电极植入后脑内生物大分子会在电极表面吸附,导致电极检测灵敏度下降,使得电极必须在活体检测后进行校正,才能对活体数据进行分析。Liu等发现,用牛血清蛋白(Bovine serum albumin,BSA)處理后的CNT修饰CFE电极的活体检测前校准曲线和活体检测后校准曲线基本一致,从而巧妙地实现了活体前校准,克服了活体检测过程中或者活体分析后微电极取出时电极断裂无法校准的问题。