热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
目的探索硫化氢对异丙肾上腺素所致豚鼠乳头肌早后除极及触发活动的影响。方法应用细胞内玻璃微电极技术记录豚鼠乳头肌动作电位,用异丙肾上腺素诱发早后除极和触发活动,观察硫化氢对早后除极和触发活动的影响。结果1)含异丙肾上腺素(50 nmol/L)的K-H液灌流可引起豚鼠右心室乳头肌产生早后除极并出现触发活动,有时触发活动会出现持久的节律性活动。2)NaHS(100、200μmol/L)预处理可显著降低异丙肾上腺素诱发的早后除极波幅及发生率和触发活动的发生率(**P<0.01),NaHS 200μmol/L还明显延长早后除极的潜伏期(*P<0.05)。结论硫化氢抑制异丙肾上腺素所致早后除极及触发活动的发生。
早后除极(early afterdepolarization,EAD)发生在动作电位(action potential,AP)尚未结束前,是在AP复极2相或3相过程中出现的膜电位的瞬时性或振荡性改变,常伴随AP时程的延长。当EAD幅度>10mV时,形成非驱性AP,称为触发活动(Triggerd activity,TA)。许多临床和实验室研究均表明EAD和TA在QT间期延长中发挥重要作用,导致长QT间期综合征,由此引起人们对EAD研究的高度重视。
硫化氢(H2S)作为继一氧化氮(nitric oxide,NO)、一氧化碳(CO)之后的第三种新型内源性气体信号分子,它不但可以在体内内源性的产生,并发挥重要的生理调节功能。研究发现它对于整个心血管系统的调节具有重要的作用。而目前H2S与疾病关系的研究较少,有关H2S在一些心血管疾病如心律失常方面作用的研究尚未见报道。本文采用微电极技术,研究硫化氢对异丙肾上腺素(Iso)所致豚鼠离体心室乳头肌EAD及TA的影响,旨在为硫化氢的抗心律失常作用提供依据。
1、材料与方法
1.1主要试剂
硫氢化钠(NaHS),购自美国Sigma公司,其它试剂均为国产分析纯。
1.2实验动物
健康纯色雄性豚鼠8只,体重300~400 g。
1.3主要实验仪器
多道生理信号采集处理系统RM6240BDJ型、微电极放大器SWF-2型、数字式超级恒温浴槽HSS-1型、微电极拉制仪WD-1型均购自成都仪器厂,微推进器CZ-6型(上海仪表机械制造厂)、电子蠕动泵DDB-300型(宁波石浦海天电子仪器厂)、酸度计SPM-10A型(梅特勒-托利多仪器上海有限公司)。
1.4营养液成份
正常K-H液成分(mmol/L):NaCl 118.0,KCl 4.7,CaCl22.5,MgSO4·7H2O 1.6,KH2PO41.2,NaHCO325.0,葡萄糖11.1。
1.5方法
将豚鼠击昏后迅速打开胸腔,取出心脏,置于95%O2、5%CO2氧饱和的0~4℃K-H液(pH值7.38±0.03)中,轻轻挤出积血,沿前室间沟右缘剪开右心室,选择分支少、大小约0.6mm×1mm×3mm的柱状乳头肌,用线结扎腱索端剪下乳头肌,用不锈钢针固定于标本槽底部的硅胶上。用35.5±0.5℃的K-H液恒温恒速灌流乳头肌,流速为4mL/min。将尖端电阻10~20MΩ、充灌KCl(3mol/L)的玻璃微电极尖端插入乳头肌标本,由刺激器提供波宽1ms,频率2Hz,强度为1.5倍阈刺激的方波信号以场刺激驱动标本,生物电信号经微电极放大器放大后,经RM6240BDJ型多道生理信号采集处理系统输入计算机。标本在正常的K-H液中平衡1 h后,改用含Iso(50 nmol/L)的K-H液灌流,诱发EAD和TA,记录EAD的潜伏期、幅值和发生率,TA的发生率。然后分别预先用含NaHS(50μmol/L、100μmol/L、200μmol/L的K-H液灌流10min,随后再加入含Iso(50 nmol/L)的K-H液灌流标本,记录EAD和TA各参数,最后用KH液冲洗至AP恢复正常。
2、结果
2.1异丙肾上腺素诱发早后除极及触发活动特性
Iso 50 nmol/L使豚鼠乳头肌AP的复极时间明显延长,但不影响除极过程。在延长复极时间的过程中,可诱发豚鼠乳头肌出现EAD,并可发展为TA,甚至可见TA发展为持久的节律性活动,此外,有的还会伴有迟后除极的出现。
2.2硫化氢对Iso所致早后除极及触发活动的影响
NaHS 50μmol/L对Iso所诱发的豚鼠乳头肌早后除极和触发活动无明显影响,NaHS 100μmol/L可显著降低EAD幅度及EAD和TA发生率,NaHS 200μmol/L还明显延长TA潜伏期。见表1。
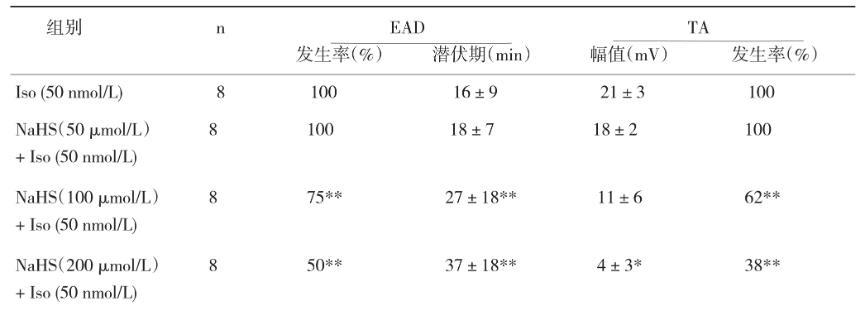
表1 HS对Iso所致豚鼠乳头状肌EAD及TA的影响(±s)2
*P<0.05,**P<0.01。
组别n EAD TA发生率(%)潜伏期(min)幅值(mV)发生率(%)Iso(50 nmol/L)8 100 16±9 21±3 100 NaHS(50μmol/L)8 100 18±7 18±2 100+Iso(50 nmol/L)NaHS(100μmol/L)8 75**27±18**11±6 62**+Iso(50 nmol/L)NaHS(200μmol/L)8 50**37±18**4±3*38**+Iso(50 nmol/L)
3、讨论
触发活动根据其时相特征分为早期后除极化(EAD)及延迟后除极化(delayed afterdepolarization,DAD)两种类型。目前认为凡能使动作电位2、3时相正离子内流增加或外流减少的因素均可延长动作电位和复极时程,从而引起EAD。Ca2+内流,可使心肌细胞动作电位平台期延长,复极时间延长而导致EAD的发生。当细胞内Ca2+超载时,肌浆网Ca2+释放增多,进一步引发EAD。异丙肾上腺素通过激活心肌细胞的β2受体,进一步激活腺苷酸环化酶,进而提高细胞内cAMP水平,最终激活cAMP依赖性蛋白激酶,而达到增加Ca2+内流。细胞内Ca2+超载又将引起肌浆网Ca2+释放增多,加重细胞内Ca2+超载,进一步促进EAD的发生。
内源性H2S是由L-半胱氨酸在磷酸吡哚醛-5'-磷酸依赖性酶,即胱硫醚-β-合成酶(cystathionie-βsythase,CBS)和胱硫醚-γ-裂解酶(cystathionine-γlyase,CSE)、半胱氨酸转移酶等催化作用下产生的。在心血管系统内源性H2S主要是通过CSE催化产生。现有的研究报告表明H2S能够浓度依赖性地缩短离体豚鼠乳头肌的动作电位时程,降低动作电位幅值和超射值,减慢零相最大上升速度,其机制可能通过兴奋KATP通道促进K+外流,同时抑制Ca2+内流,进而影响豚鼠乳头状肌电生理效应。到目前为止,H2S被确认为第一个作用于血管平滑肌细胞KATP通道的气体开放剂,在心肌细胞上也有KATP通道的广泛分布。有文献报道,H2S可借助KATP通道的开放,使钾离子外流增加,从而造成心肌细胞膜的超极化;同时,由于钾离子外流,可抑制钙离子内流。激活KATP通道还可缩短动作电位平台期,使Ca2+内流减少,从而减轻心肌细胞内的钙超载。以上研究显示,H2S可能通过开放KATP通道,抑制钙离子内流进而抑制EAD和TA的产生,这为H2S的抗心律失常作用提供了重要依据。
 相关新闻
相关新闻