热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
背景介绍:致病性肠杆菌的毒力和一线免疫细胞(特别是中性粒细胞)的存活和功能受到氧(O2)的高度调控。最致命的肠道菌(志贺氏菌属、李斯特菌属、沙门氏菌属、致病性大肠杆菌属和鼠疫耶尔森菌属)都能很好地适应这些变化的微环境,这表明对不同O2水平的适应性是其感染能力的一个重要选择优势。肠粘膜内的志贺氏杆菌感染缺氧是通过缺氧报告基因EF5在结肠粘膜内诱导的。在对致病性肠杆菌在肠道定殖过程中,从缺氧的管腔到充氧的组织,面临不同的氧浓度(O2)水平。
本论文的研究人员以弗氏志贺氏杆菌为模型,证明了上皮细胞的侵袭是由O2以一种依赖于分泌系统的方式促进的。而对病原体对组织氧合调节的适应仍然未知。研究人员应用氧气微电极系统对单细胞分布和组织氧合的评估,研究发现在感染过程中结肠粘膜的氧气被弗氏志贺氏杆菌的好氧习性所消耗,而非宿主中性粒细胞,从而导致了低氧感染灶的形成。研究证明这一过程是由III型分泌系统失活的感染组织,有利于定殖。从而确定了支持感染性缺氧诱导的分子机制,获得关于肠致病菌是如何优化其定殖能力,使其在感染期间能够控制组织氧合。
Unisense微电极系统的应用
O2微电极传感器(H2‐500,Unisense)用于志贺氏杆菌体的直接氧消耗测量。使用unisense微剖面研究系统(Unisense)和穿刺针式微电极传感器(OX-NP)。在气密玻璃可戳管(BD真空采集器)中进行直接氧消耗定量。使用Unisense传感器跟踪记录器软件记录数据。具体测试过程是,首先在厌氧柜(MiniMACS DG250;Don Whitley)中打开玻璃管30分钟,以确保从管(缺氧大气)中去除所有外源氧的痕迹。随后用2毫升培养基填充这些培养管,并在37°C和pO2=40 mmHg(5%O2)的缺氧室内预稳定。在接种之前,在类似的条件下培养细菌(弗氏志贺菌5a野生型和突变株、大肠杆菌、鼠伤寒沙门氏菌、单核细胞增多症杆菌、金黄色葡萄球菌或干酪乳杆菌),直到OD600=0.3。细菌单独或与中性粒细胞一起在RPMI 1640+10 mM HEPES中以指示浓度重新悬浮。当DPI以25μM的最终浓度添加时,fMLP(趋化肽和N-甲酰基肽受体(FPR)的特异性配体)(Sigma-Aldrich),以1μM的最终浓度添加。随着时间的推移,使用unisense的氧气微电极对试管内直接进行O2定量测试,并在细菌或细胞接种后立即开始。
实验结果
研究结果表明侵袭性病原体对不同氧气水平的适应是组织定殖的必要条件。而非兼性厌氧菌的致病微生物是非侵入性的。致病性肠杆菌消耗氧气可能被视为一种社区行为,例如结肠炎症模型中的氧气可用性和细菌对这些病理生理环境的适应。研究发现在肠道定殖过程中,弗氏志贺菌通过有氧呼吸消耗肠道粘膜中的氧气以促进其定殖。氧气促进了弗氏志贺菌对上皮细胞的侵袭,这一过程依赖于III型分泌系统,但弗氏志贺菌如何适应组织中的氧化环境尚未明确。在肠道定殖过程中,弗氏志贺菌通过其有氧呼吸作用消耗结肠粘膜的氧气,导致感染位点形成低氧环境。上述过程无需中性粒细胞的参与且抑制弗氏志贺菌的III型分泌系统的活性可促进低氧环境的形成。弗氏志贺菌与免疫细胞的互作主要发生在无氧条件下。
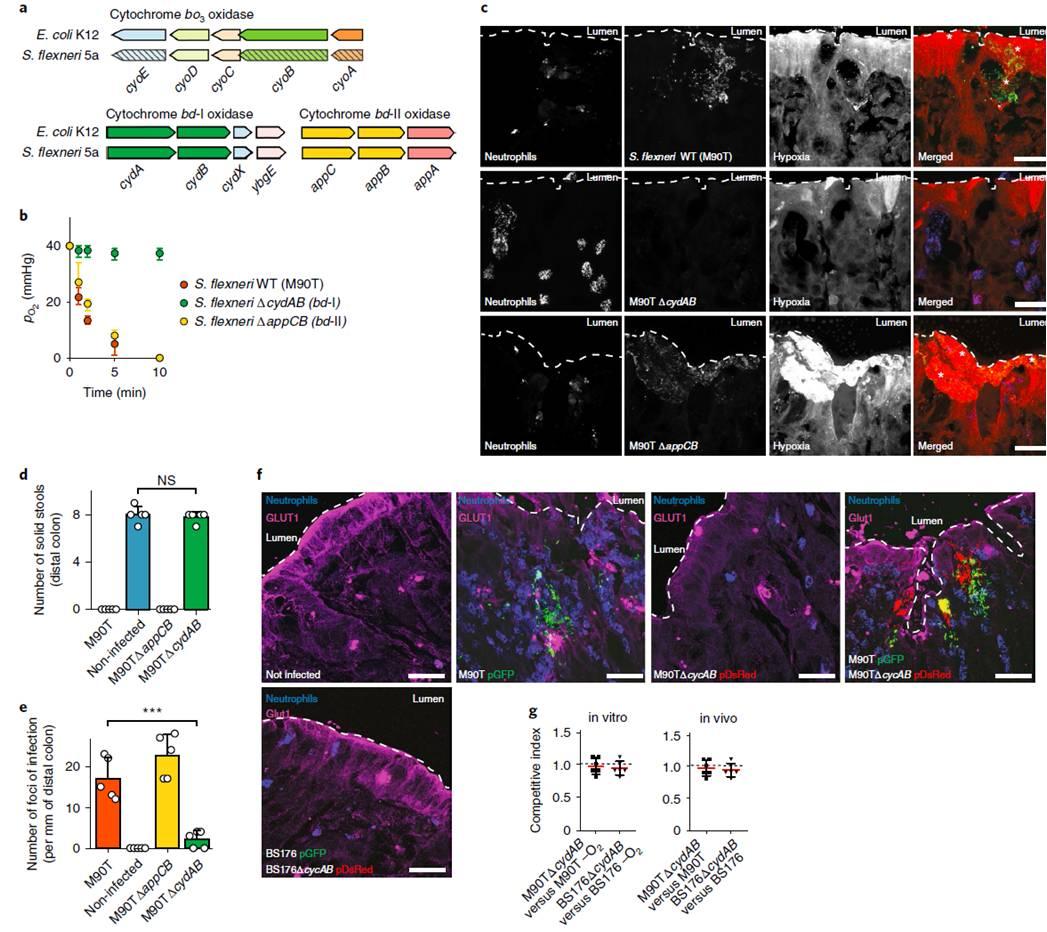
图1、缺氧是由志贺氏菌在感染灶内特异性诱导的。a)用EF5报告基因法检测感染S.flexneri 5a pGFP株(绿色)后8 h豚鼠结肠粘膜组织的缺氧情况.b)结肠粘膜的缺氧情况。EF5水平被报道为所有对齐剖面(粗线)±s.d(阴影区域)相对于组织深度的平均值(n=128、61和48个剖面,分别适用于M90T、未感染(UI)和无EF5条件)。C)通过定量图像分析检测到单个细菌,并将其中两个种群定义为S.flexneri.d)检测感染后8小时结肠粘膜内聚集和分散的细菌群.e,f)通过定量图像分析比较单个分散和聚集的细菌水平的缺氧水平(在e中成像,在f中定量).g)单个中性粒细胞(橙色圆点),染色骨髓跟踪,定量图像分析定位于组织.h)与分散的细菌相比,中性粒细胞更接近聚集的细菌。i)在中性粒细胞周围检测到的缺氧(EF5)水平(在五个最接近的地方的平均值)在聚集的细菌周围要高于分散的细菌。

图2、感染组织中嗜中性粒细胞对O2耗竭不是必需的,这主要是由志贺氏菌的有氧呼吸引起的。a)感染后8小时,在常规和中性粒细胞减少豚鼠结肠粘膜中检测到弗氏志贺菌(绿色)感染灶。用Myelotracker-Dylight405标记中性粒细胞(蓝色),抗ef5-cy3免疫检测低氧(红色)。b)在同一范围内聚集细菌周围的缺氧水平。c-d)将聚集的(感染部位)和分散的弗氏志贺菌(绿色)群体的细胞密度可视化(c)并在体内定量(d)。e)使用氧气微电极在RPMI 1640+10mm HEPES的培养基中测定体外耗氧量,在缺氧条件下密封的试管中稳定在40 mmHg(低氧室).f)按指示浓度(t=0)接种成指数增长的细菌培养物,在体内(d)或在5×109热处理的S.flexneri存在的情况下计算周围聚集和分散的种群密度。O2消耗率(O2分压)弗氏志贺菌的细菌密度相关。g)同时存在弗氏志贺菌和中性粒细胞的O2消耗率(O2分压表示)。
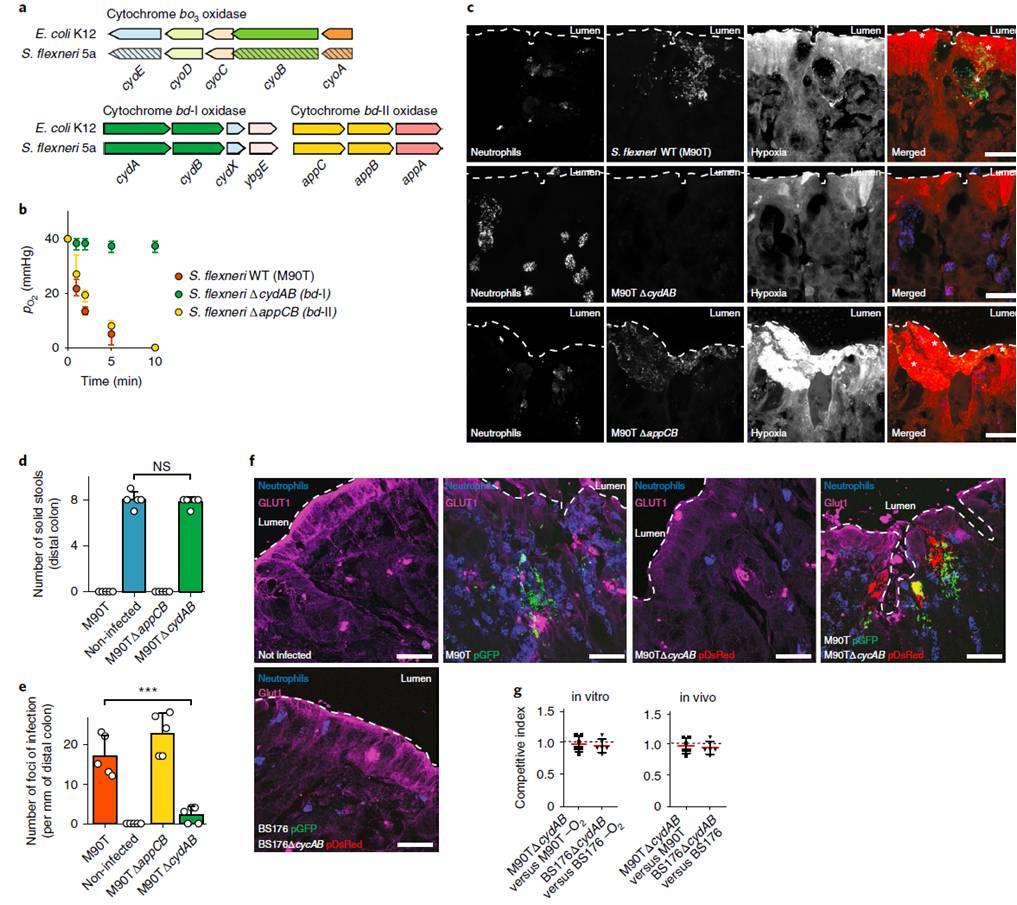
图3、缺氧诱导和体内弗氏志贺菌对结肠粘膜的高效定殖需要通过有氧呼吸消耗肠道粘膜中的氧气。a)细胞色素氧化酶(bo3、bd-I和bd-II)编码大肠杆菌K12和弗氏志贺菌5a基因的遗传结构。B)弗氏志贺菌ΔcydAB(bd-I)无法消耗试管内氧气(培养基为RPMI 1640+10Nmhepes),其氧分压稳定在PO2=40毫米汞柱,在O2存在下会受到增长的缺陷。c)弗氏志贺菌ΔcydAB(bd-I)(绿色)是体内无毒的,和WT型、ΔappCB型相比(bd-II),突变菌株8 h后感染。用ef5-cy3抗体(红色)和Myelotracker-Dylight405检测缺氧和中性粒细胞(蓝色)。白色星号表示感染灶。d)组织感染ΔcydAB应变不发炎与WT型菌株应变相比,所表示在结肠内腔内固体粪便的存在。E)与WT株相比,感染ΔcydAB株的组织中的感染灶数量显著减少.f)在弗氏志贺菌(绿色)感染8小时后,用单克隆抗体(品红)检测GLUT1。G)在体外共培养(O2条件)和豚鼠体内共感染(管腔和结肠粘膜)中测定了M90T/M90TΔcydAB和BS176/BS176ΔcydAB竞争指数。
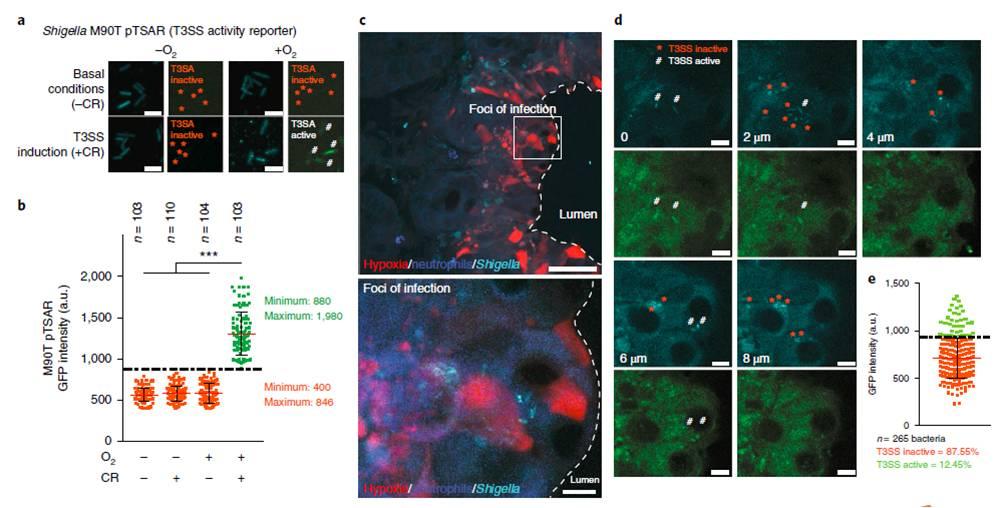
图4、弗氏志贺菌T3SS在结肠粘膜中是不活跃的,支持感染病灶扩展。a,b)在刚果红(CR;0.01%)存在的情况下,使用活性受体pTSAR16在体外证实了弗氏志贺菌T3SS1的氧依赖性调制(a中成像,b中量化)。c)在感染后8h,在体内单个细菌水平上,对弗氏志贺菌T3SS形成的缺氧感染灶中的T3SS的活性进行评估。d)Z-stack图像系列显示了T3SS活跃的细菌(白色标签)和T3SS不活跃的细菌(橙色星号)。e)结果的量化显示在图d中。大多数在缺氧感染灶内检测到的弗氏志贺菌pTSAR个体细菌有一个不活跃的T3SS。

图5、用大肠埃希菌、鼠伤寒沙门氏菌、单核细胞增生李斯特菌、鼠疫耶尔森菌(兼性厌氧菌)结合unisense氧气微电极来评估耗氧率,在指定的细胞密度下评估氧分压。
结论与展望
本论文主要研究了关于在肠道定殖过程中,肠道致病菌-弗氏志贺菌是如何通过有氧呼吸消耗肠道粘膜中的氧气以促进其定殖。研究人员使用了unisense氧气微电极(OX-NP针式微电极)研究致病性肠杆菌在肠道定殖过程中氧的消耗,研究发现从缺氧的管腔到充氧的组织,都会面临不同的氧浓度(O2)水平。通过对所测试获得的氧浓度的数据跟踪,发现弗氏志贺菌通过有氧呼吸消耗肠道粘膜中的氧气以促进其定殖。氧气促进了弗氏志贺菌对上皮细胞的侵袭,而这一过程依赖于III型分泌系统,并且无需中性粒细胞的参与且抑制弗氏志贺菌的III型分泌系统的活性可促进低氧环境的形成。这也说明了弗氏志贺菌与免疫细胞的互作主要发生在无氧条件下。从上述的研究结果中可以看出,unisense氧气微电极在研究人员得出关于感染性致病菌的缺氧诱导的分子机制中提供了重要的数据支持,并很好的解释了肠致病菌是如何优化定植能力,使其在感染期间能够控制组织氧合过程。