热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
癫痫在从出生窒息中恢复的新生儿中很常见,但人们普遍认为目前的药物治疗效果不佳,需要新的抗癫痫药物。苯巴比妥(PhB)是新生儿癫痫发作的一线治疗药物,12包括由HIE引起的癫痫发作,但它在治疗的前24小时内仅抑制40%–80%的新生儿癫痫发作。最近在出生窒息的大鼠模型中表明,癫痫发作是由窒息后脑pH值的恢复引发的。脑pH调节多种离子通道的功能,这些离子通道控制神经元兴奋性和突触信号传导。这些通道以功能协同的方式响应pH值的变化,因此酸中毒抑制神经元兴奋性和癫痫发作,而碱中毒增强神经元兴奋性和癫痫发作。
本论文研究目的是研究诱导全身性酸中毒的碳酸酐酶抑制剂(CAI)是否能阻断窒息后癫痫发作。研究了CA抑制剂(CAIs)、乙酰唑胺(AZA)、苯甲酰胺(BZA)和乙恶唑胺(EZA)对足月出生大鼠模型中癫痫发作时对应的脑的pH值和脑P o 2的影响。
实验步骤
用4.5%异氟醚空气麻醉幼鼠,腹腔注射1.0 mg/g氨基甲酸乙酯,置于35℃加热垫上。手术时异氟醚浓度降至2.5%~1.5%。将由30号针头组成的导管连接到带有10厘米PE10聚乙烯管并预填充0.9%NaCl的注射器,插入侧尾静脉并用氰基丙烯酸酯胶固定到位。取出一块头皮,在顶叶皮层两侧钻出颅窗,使用unisense微电极系统老鼠大脑内pH值和O 2的测试(A/P-4.5,M/L 2.0 mm,距前脑门,右侧pH传感器),左侧枕顶叶皮层上方,用于局部场电位(LFP)电极并在小脑(从lambda的尾部和侧面约1毫米)上连接地线。在六只动物中,在下背部切开皮肤切口(长度:2-3 mm),用于测量老鼠体内的pH值和PO 2。unisense的pH(Unisense pH-500)和P o 2(Unisense OX-N)探针从麻醉后的老鼠皮肤切口推进到皮下空间至少10 mm。用细针尖小心地切开老鼠颅窗下的硬脑膜,用pH微传感器(Unisense pH-25)、O2微电极微传感器(Unisense OX-10)和一个玻璃毛细管LFP电极(填充溶液:150 mM NaCl)插入到大脑皮层约1 mm处,将Ag/AgCl接地线硬膜外放置在老鼠的小脑上。
实验结果
三种CAIs可降低脑pH值0.14~0.17个pH单位,抑制窒息后癫痫电图。AZA、BZA和EZA在脂溶性(EZA>AZA>BZA)和药代动力学方面存在较大差异。然而,腹腔注射对脑ph的影响只有轻微的延迟(0.8-3.7分钟)差异。CAIs诱导了窒息后脑Po2的适度升高,但对LFP活性没有影响。AZA在行为自由的大鼠身上进行了试验,它诱发了呼吸性酸中毒,并将惊厥发作的发生率从20只中的9只降低到17只中的2只。
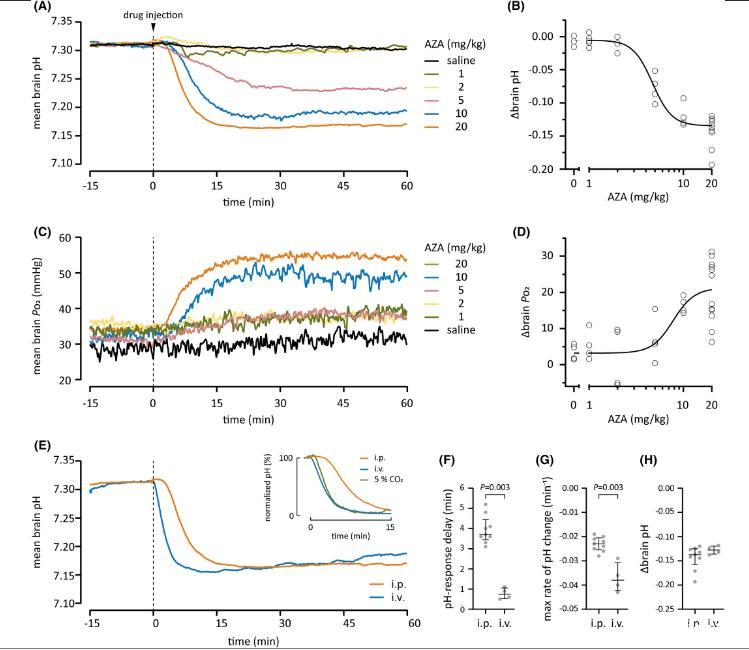
图1、乙酰唑胺(AZA)对出生后第11天大鼠脑pH值和P o 2的影响。(A)腹膜内(ip)注射盐水或1-20 mg/kg AZA后老鼠脑内pH值变化的时间过程和(C)P o 2显示为连续记录的平均值。AZA(在零时间注射)导致脑pH值降低和脑P o 2增加.(B和D):注射后45-60分钟观察到的AZA作用的剂量依赖性显示20 mg/kg剂量对脑pH值的饱和作用。(E)IP和静脉内(iv)注射20 mg/kg AZA(n=9和4)后脑pH值平均变化的时间过程。带有归一化y轴的插图显示了与吸入5%CO 2(n=5)的效果相比的相同数据。静脉注射AZA和CO 2后脑酸中毒的发展速度相当吸入。注射AZA的延迟、最大速率和幅度。与静脉内给药相比,腹腔内给药后脑pH值的下降具有较长的发作延迟,定义为从注射到最大变化的10%(F)的时间,并且以较低的速率(G)发生。(H)两种给药途径在注射后45-60分钟的脑pH值没有差异。(FH)中的条形表示中位数和四分位距。
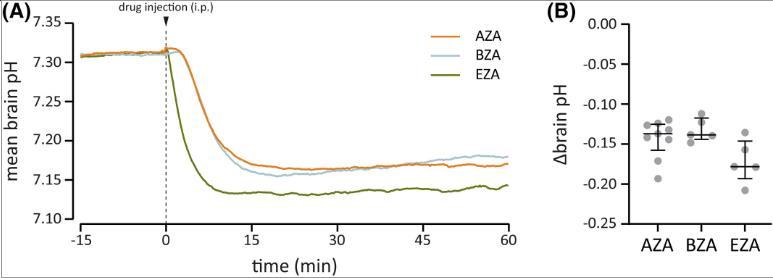
图2、碳酸酐酶抑制剂乙酰唑胺(AZA)、苯甲酰胺(BZA)和乙恶唑胺(EZA)对脑pH值的影响。(A)腹腔(ip)注射20 mg/kg AZA或等摩尔剂量(90µmol/kg)BZA或EZA后脑pH值平均变化的时间过程。与AZA或BZA相比,注射EZA后脑pH值下降得更快。注射后45-60分钟记录的脑pH变化幅度(B)在药物之间没有差异。(B)中的条形表示中位数和四分位数范围。
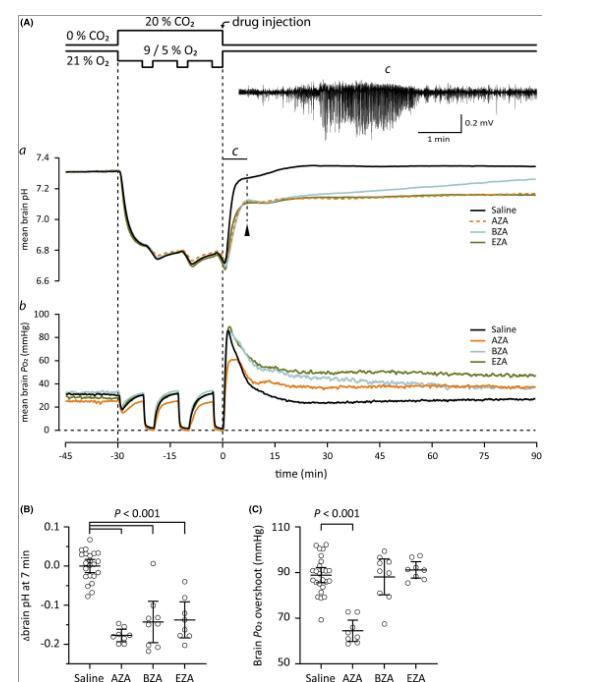
图3、碳酸酐酶抑制剂(CAIs)乙酰唑胺(AZA)、苯甲酰胺(BZA)和乙恶唑胺(EZA)对窒息后老鼠脑内pH值和Po 2的影响。(A)顶部的线图显示了窒息后恢复开始时的气体应用方案和静脉注射药物(90µmol/kg)的时间。垂直虚线标记窒息的开始和结束。窒息结束时,脑pH(a)严重酸中毒,脑P o 2(b)几乎为零。恢复室内空气后,大脑pH值快速增加7分钟(快速恢复阶段结束,用箭头标记)之后慢慢稳定在基线水平附近。Brain P o 2超过基线水平,随后迅速恢复至基线。癫痫发作总是出现在大脑pH值恢复的快速阶段。插图(c)中显示了在这7分钟期间内注射盐水的大鼠中记录的样本局部场电位。快速pH恢复阶段(7分钟)结束时的脑pH值显示在B中。盐组平均pH值已从值中扣除。用任何CAI治疗的动物的脑pH值较低。(C)脑P o 2在过冲的峰值。
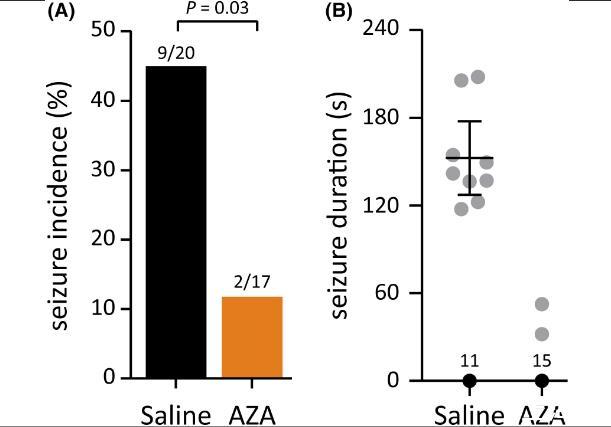
图4、乙酰唑胺(AZA)可抑制窒息后惊厥发作。自由活动大鼠中阵挛和/或强直阵挛窒息后癫痫发作的发生率(A)和持续时间(B)。窒息结束前10分钟腹腔给予20mg/kg AZA或生理盐水。
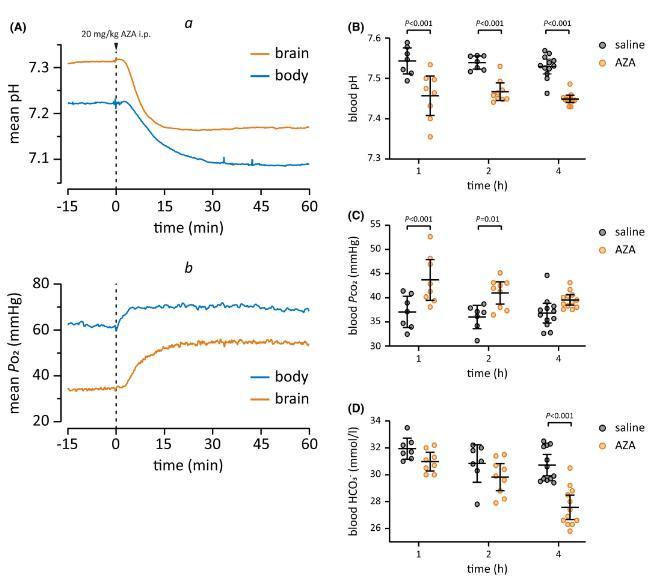
图5、乙酰唑胺(AZA)可诱导快速、短暂的呼吸性酸中毒和延迟性代谢性酸中毒。(A)腹膜内(ip)注射20 mg/kg AZA后皮下(“身体”)和脑pH(a)和P o 2(b)变化的时间过程,显示为连续记录的平均值(n=5代表身体,12代表大脑记录)。在基线期间,身体pH值略低,P o 2远高于大脑。AZA注射后身体和大脑的pH值降低了相似的量。P o 2的平行增加在大脑中比在身体中更为突出。血液pH(B),Pco 2(C)和HCO3-浓度(D)腹腔注射20 mg/kg AZA后1-4小时(2小时第二次给药)。
结论与展望
本论文研究了CA抑制剂(CAIs)、乙酰唑胺(AZA)、苯唑胺(BZA)和乙氧唑胺(EZA)对足月窒息大鼠癫痫发作、脑pH和脑Po2的影响。研究表明CAIs以类似于外源性CO 2的方式抑制出生窒息大鼠模型中的癫痫发作。24在临床上使用易于给药的药物显然比使用5%CO2吸入要简单得多。现在判断哪种特定的CAI药物在治疗新生儿窒息后癫痫发作中是最佳的(参见30)还为时过早。然而,现有的临床数据表明AZA在新生儿和儿科人群中具有很高的安全性和耐受性,这表明这种抗癫痫药物可用于NICU。AZA、BZA和EZA可有效阻断窒息后癫痫发作。尽管它们的药代动力学存在差异,但它们对脑pH值的影响相似,这表明它们的抗癫痫作用模式是基于抑制血源性和细胞外血管碳酸酐酶导致的呼吸性(高碳酸血症)酸中毒。AZA已被用于新生儿的多种适应症,这表明它可以安全地重新用于治疗新生儿癫痫发作,作为当前治疗方案的补充。