热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
电化学影响下的缝内离子浓度
由于缝隙内只存在氧气的还原反应,并且产生OH-,溶液中的阴离子和阳离子会发生迁移以保持电中性原则。如图5所示,可以更直观地展现出金属阳离子在溶液中的浓度变化情况。模拟结果表明,在距缝口约30 mm处Na+浓度达到峰值,约为外部溶液浓度的6.6倍,随着缝隙深度的增加,Na+浓度急剧降低,在缝隙最深处Na+浓度的最小值和缝隙外部的保持一致。缝隙深处由于缝隙过于狭窄,Na+的扩散速率急剧降低,因此无法向缝内传质,Na+的迁移导致阴极电流无法到达缝隙深处,影响了阴极保护的效果。
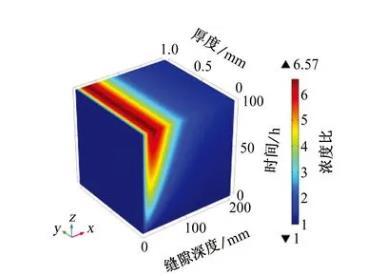
图5缝内Na+浓度与初始条件下Na+浓度的比值随时间和缝隙深度的变化
根据电中性条件的假设,随着缝隙内OH-浓度的增加,SO42-应向缝隙外部迁移,从图6中可以看出,缝隙深度为0~25 mm,SO42-浓度比下降到0.3以下,最低值为0.12。可见阴离子浓度受传质效应控制,缝隙口的电位梯度大,并且缝口与缝隙外部溶液中离子的扩散传质受缝隙形状影响较小,所以SO42-浓度迅速下降。在缝隙深处由于受到环境限制,SO42-浓度变化较慢。
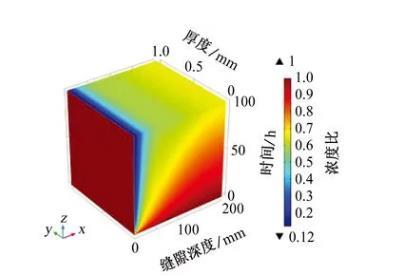
图6缝内SO42-浓度与初始条件下SO42-浓度的比值(简称浓度比)随时间和缝隙深度的变化
根据以往的模拟和试验结果,由于溶液保持电中性,Na+向缝隙内部迁移,同时向缝隙外部扩散,Na+浓度与OH-浓度近似相等,这与本模型的模拟结果基本一致。
溶液电导率的影响
模型中电导率(σ)可以用如下方程表示
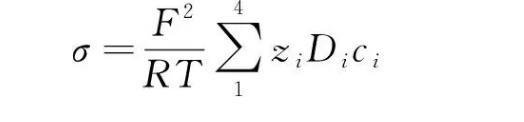
从上式中了解到,溶液的电导率与阴阳离子浓度密切相关,从图7中可以直观地看出缝内溶液电导率的变化,缝隙中电导率整体呈现上升趋势,且随着时间的增加而增加、随深度的增加而减小,这与WANG等的试验结果相一致。根据前面章节的数据分析,由于缝隙内发生了氧气的还原反应,造成了OH-浓度的升高,为了保持缝内溶液的电中性,阳离子(Na+)向缝内迁移,阴离子(SO42-)向缝外扩散,因此在缝口处的离子传质运动剧烈,造成电解质溶液电导率大大增加,最大值约为本体溶液的4.2倍。但是缝隙底部的电位梯度和电流密度远远小于缝隙口附近的,所以电导率虽然因离子的传质而增加但是远没有缝口附近电导率增加的快。与此同时,由于受到缝隙形状和电位梯度的限制,Na+和SO42-只能在距缝口大约100 mm有限距离内进行传质运动。综上分析可知,电解质电导率的模拟结果与前几节得到的结果一致。
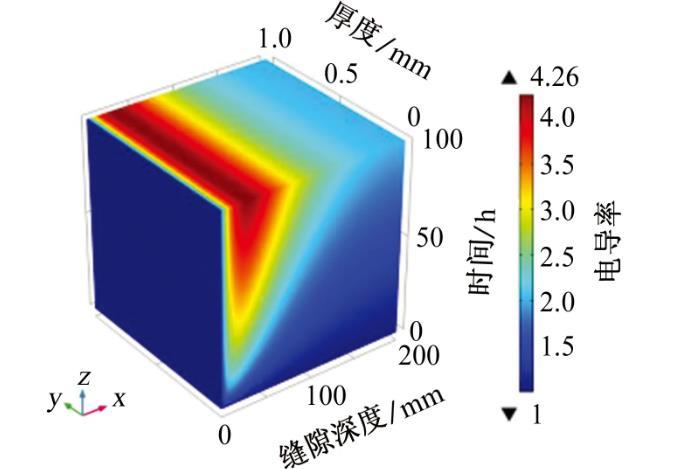
图7溶液电导率与初始条件下溶液电导率的比值随缝隙深度和时间的变化
模拟计算结果与试验测量结果的比较
本工作参考了CHEN等的试验研究,并与之进行比较,以说明模拟的准确性。试验采用X70管线钢,试验条件如下:以0.01 mol/L Na2SO4溶液作为土壤模拟溶液,pH为6.8,温度为室温(22℃),缝隙深度为30 cm,厚度为0.9 mm,阴极保护电位为-1 000 mV。
如图8、图9和图10所示,通过数据对比,模拟结果和试验结果的平均误差为1.8%,这种偏差可能是模型的假设与实际情况仍存在差距所致。
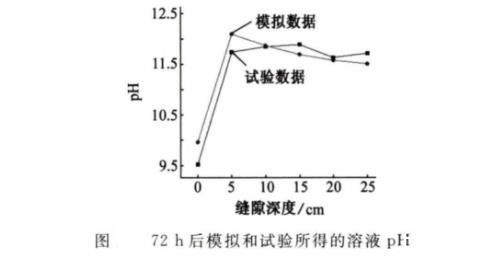
图8 72 h后模拟和试验所得的溶液pH
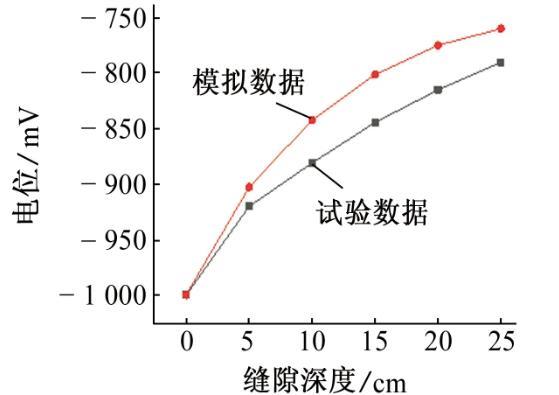
图9 72 h后模拟和试验所得的缝内电位
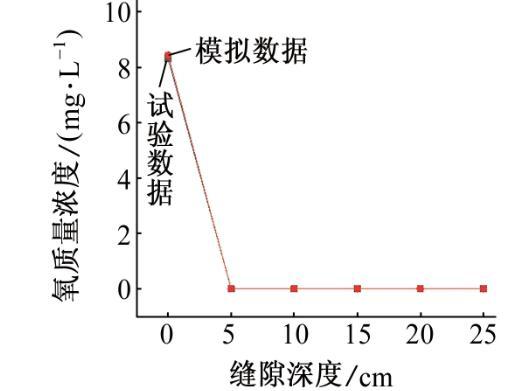
图10 72 h后模拟和试验所得溶液的氧质量浓度
结论
(1)在结合前人的数学模型的基础上,开发了一个涂层下缝隙腐蚀的二维瞬态模型,将缝隙内化学物质的传质、还原反应和水的电离统一,利用有限差分法解决了方程的求解问题,模拟了阴极保护条件下,缝隙内化学和电化学反应随时间的演变,模拟结果与试验数据吻合度较好,两者平均误差为1.8%。
(2)当缝内溶液含有溶解氧时,缝内发生氧的还原反应,氧气被消耗,在有阴极保护电流的情况下,在距缝口1.5 mm处溶液pH出现峰值,此处氧气被消耗殆尽,并且由于电中性和缝隙形状的特殊性,使得氧气无法进一步向缝内扩散。
(3)本模型添加水的电离效果,当溶解氧被还原生成OH-的同时还有少部分OH-来自水的电离,这使模拟效果更佳贴合实际。在阴极保护条件下,缝内溶液的pH显著上升,在缝隙口处达到峰值,并随着时间的推移逐渐趋于稳定。而在高碱性环境中,缝隙内部的金属表面会形成钝化膜从而使其腐蚀速率降低,即使缝隙深处未受到阴极保护也能延缓腐蚀的发生。
(4)缝隙中由于电迁移传质和浓度梯度影响下的扩散,使阳离子向内、阴离子向外运动,同时由于还原反应使缝口处OH-浓度迅速升高,导致溶液电导率随时间的延长而增加,并且随着深度的增加而减小。
 相关新闻
相关新闻