热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
3电极抗蛋白质吸附的策略
蛋白质的非特异性吸附过程非常复杂,一般认为是由于蛋白质和电极表面强的相互作用引起的。这种相互作用主要包括静电吸引/排斥相互作用、疏水/亲水相互作用、氢键和偶极相互作用。研究表明:吸附过程一般不是由单一的某种相互作用决定的,而是由这些相互作用协同完成的。由于在水体系中,蛋白质吸附时其疏水相互作用的强度更大,所以许多减少表面蛋白质非特异性吸附的主要策略是增加电极表面的亲水性。近年来,研究人员使用一系列抗蛋白质吸附的方法和策略,如调控特殊的电极表面形貌和使用涂层修饰电极表面等方法,旨在减少蛋白质在电极表面的非特异性吸附,从而提高电极对待检测物检测结果的准确性和可靠性。
3.1构筑特殊结构的电极表面
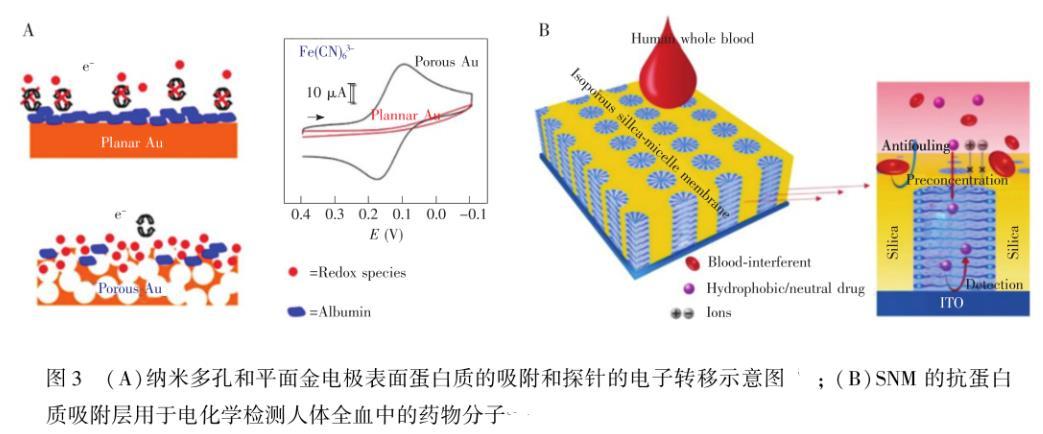
目前,特殊表面形貌的构筑主要集中在多孔电极的制备,因多孔结构能够增加电极的孔隙率和表面积、暴露更多的电化学活性位点、以及阻止蛋白质到达孔电极内表面,从而降低蛋白质吸附对电极灵敏度造成的不利影响。Collinson研究组制备了不同大小孔径的金电极,分别使用铁氰化钾、六氨合钌、二茂铁甲醇作为电化学探针,研究了不同孔径对蛋白质非特异性吸附的影响。他们发现具有纳米孔的金电极在2 mg/mL牛血清白蛋白(BSA)溶液中浸泡1 h后,电极的灵敏度未发生明显变化。相比之下,金盘电极、大孔和分级孔的金电极的电流响应大幅度降低(图3A)。纳米孔电极提高抗蛋白质吸附性能主要是因蛋白质能够吸附到纳米孔金电极表面,但无法扩散到孔结构的内表面,但分子量较小的探针可扩散到纳米孔结构的内表面而发生氧化还原反应,从而在宏观上减少蛋白质吸附对纳米多孔金电极电化学性能的不利影响。该研究组通过脱合金方法制备了抗蛋白质吸附的纳米多孔金电极,在BSA存在的情况下,实现了对抗坏血酸(AA)和尿酸(UA)的同时检测。Daggumati等用DNA探针修饰纳米多孔金电极,在胎牛血清(FBS)和BSA存在的情况下检测了DNA分子,他们发现蛋白质的吸附导致检测信号仅降低了5%,表明纳米孔电极能有效提高抗蛋白质吸附的性能。
Sun等制备了孔道内含有表面活性剂的超薄等孔径二氧化硅膜(SNM),将其应用于电化学传感器的抗蛋白质吸附。该电化学传感器可直接检测全血(无需预处理)中的药物,并表现出优异的抗蛋白质吸附能力。这主要是由于:(1)直径约2.3 nm的超小型通道的尺寸筛分能力,它只允许小的亲脂性/中性待测物渗透到SNM中并富集,随后被电极检测到;而大的、带电的和亲水性物质不能通过孔道到达电极表面;(2)高密度的、规则的、垂直排列的通道具有的高渗透性和低阻抗效应,保证了物质的传递和电子转移(图3B)。
除此之外,蛋白质在不同形貌、不同粗糙度的电极表面的吸附性能也有所差异。通常,电极表面结构的变化(粗糙度)会加强其表面的亲水性或者疏水性。Narasimhan等利用两种不混溶聚合物(聚甲基丙烯酸甲酯和聚苯乙烯)之间的相分离,在基底上形成了具有不同长径比的Si3N4阵列。他们发现当Si3N4长径比为0.45时,该Si3N4膜表面显示出较小的水接触角,他们将该膜作为光机械传感元件,开发了一种微型植入式的长期眼内压(IOP)传感器,传感器表现出优异的抗蛋白质吸附和抗炎症性能。
3.2电极表面涂层修饰
亲水性表面能够与水分子结合形成水合层,阻止蛋白质的非特异性吸附。目前,用于电极表面修饰增加电极表面亲水性的材料包括聚乙二醇(PEG),两性离子材料,仿生材料和合成肽等。Nafion,BSA,牵连蛋白,碱处理的醋酸纤维、壳聚糖和PEDOT:Nafion等也被用于抗蛋白质吸附材料。通常,抗蛋白吸附材料通常遵从Whitesides规则:(1)存在极性官能团;(2)存在氢键受体;(3)不存在氢键给体;(4)呈电中性。
PEG是一种无毒、高亲水的生物相容性聚合物,被广泛用于减少蛋白质的非特异性吸附。其抗蛋白质吸附性能主要归因于表面的水合作用和空间位阻效应。其中,PEG表面填充密度和聚合物链长度均会影响PEG防污性能。填充密度越大和链越长在一定程度上会增强表面防污能力。目前,PEG的表面功能化有两种方法:(1)通过将制备的PEG吸附到表面上;(2)通过表面引发基团原位生长PEG。其中,PEG自发的自组装可获得高的表面覆盖度。Luo研究组将PEG和三磷酸腺苷(ATP)适配体自组装在聚多巴胺(PDA)修饰的电极表面,开发了一种高灵敏、抗蛋白质吸附的ATP传感器。该传感器表面能显著降低蛋白质的非特异性吸附,以及蛋白质对电子(电荷)转移造成的影响。该研究组进一步报道了用于检测人血清中乳腺癌易感基因(BRCA1)的PEG化聚苯胺(PANI/PEG)纳米纤维修饰玻碳电极(GCE)的传感器。该传感器在未稀释的人血清中孵育后,生物传感器保留了92.17%的初始电流。尽管PEG作为抗蛋白质吸附材料具有很强的吸引力,但对长期应用来说,抗蛋白质吸附能力会受到PEG聚醚结构和末端羟基易受氧化和热降解的限制。此外,长链PEG防污非导电聚合物的接枝可形成具有高阻抗的电极涂层,也会导致电极灵敏度的降低。两性离子聚合物作为具有正电荷和负电荷官能团的电中性材料,由于其强偶极子和静电相互作用,可形成具有氢键和离子溶剂化稳定的、致密的水合层,因此两性离子聚合物表现出比其它亲水/疏水材料(如PEG)更优异的抗蛋白质吸附特性。
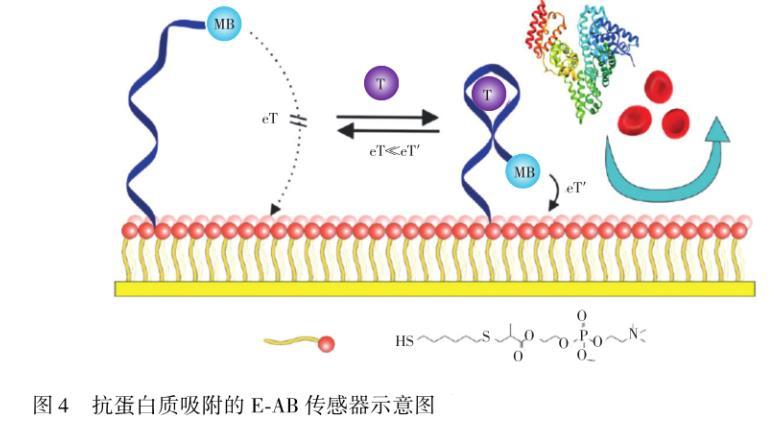
目前,两性离子抗蛋白质材料可分为3种类型:磷酸胆碱(PC),磺基甜菜碱(SB)和羧基甜菜碱(CB)。这些两性离子聚合物具有良好的稳定性和低成本等优点,有望替代目前商品化使用最多的PEG,应用于电化学生物传感器和可植入性电极中。基于PC或者PC衍生物的自组装膜均表现出优异的抗蛋白质吸附的性能和良好的电化学稳定性,其性能优于基于苯基PEG的自组装膜(SAM)。Goda等通过迈克尔型加成反应,将2鄄甲基丙烯酰氧基乙基磷酸胆碱(MPC)连接到链烷二硫醇中的一个巯基,得到一个自组装单层PC膜,该膜表现出优异的抗蛋白质吸附性能。Li等用磷脂酰胆碱(PC)自组装单层膜构筑了电化学适配体生物传感器。PC自组装膜中PC链比较短,不仅可能保证传感器的电子转移,而且能够有效阻止蛋白质或细胞在电极表面上的非特异性吸附,从而提高了传感器在全血中的分析性能。在流动体系中,检测全血12 h后基线漂移仅为10%,而未使用PC构筑的传感器降低了70%(图4)。
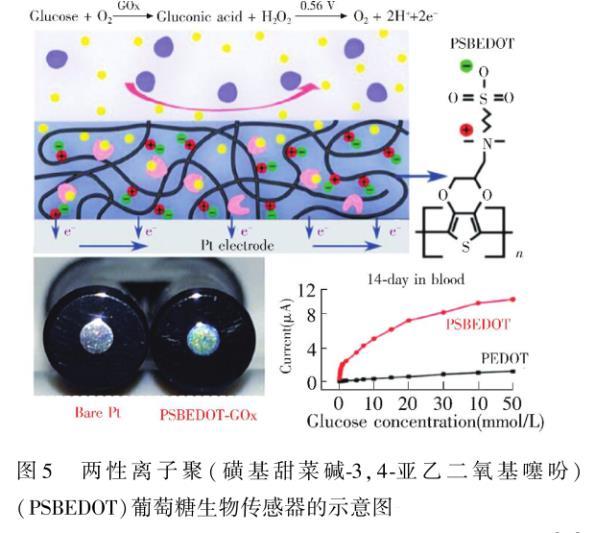
受这些天然膜分子抗蛋白质吸附性能的启发,研究者合成了多种两性离子聚合物,如SB、CB,或其类似结构的材料,其中SB和CB已被广泛用于各种抗蛋白质吸附表面的修饰。Wu等使用一步电聚合法制备了基于两性离子聚(磺基甜菜碱鄄3,4鄄亚乙二氧基噻吩)(PSBEDOT)鄄葡萄糖氧化酶(GOx)的葡萄糖传感器。结果表明,该两性离子膜具有优异的抗纤维蛋白原和血浆蛋白质吸附的性能(图5)。Hu等采用电化学介导的原子转移自由基聚合,在酶电极表面聚合两性离子磺基甜菜碱甲基丙烯酸酯单体,在未稀释的牛血清中浸泡15 d后,该电极减少了超过99%蛋白质的非特异性吸附,并且其灵敏度在15 d后仍保持在94%以上,而裸电极的灵敏度仅保留了约5%。Sun等报道了一种通过仿生甜菜碱化合物用于检测蛋白质的抗蛋白质非特异性吸附的微阵列电极。微阵列电极通过丰富的羧基和两性离子聚合物修饰,有效捕获抗体,防止了其它蛋白质的非特异性吸附。
Montiel等提出了使用暂态聚合物涂层修饰电极表面,即在特定的时间内溶解。这种暂态聚合物可通过调节涂层的特性(密度和厚度)调控溶解的速度,如2、4和6 h等,从而制备了在复杂样品中可延迟暴露新鲜电极表面的多电极生物传感器,实现了对未经处理的血液和唾液样本长时间的直接血糖监测。这种延迟传感器虽然可调控材料的组成,刺激分解的条件来实现复杂样品中某一时间的响应,但因新鲜的电极表面暴露在含蛋白质的样品中,仍会迅速被蛋白质吸附,因此不能用于长时间的连续检测。