热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
3结果与讨论
3.1环盘微电极的制备与表征
图1A为环盘电极的制备过程图,中间为CFdisk电极,并被拉制的玻璃毛细管包被,玻璃管外壁利用溅射的方法镀一层Au膜,为了形成纳米Auring电极,侧壁用石蜡绝缘。所制备的环盘电极电镜表征图如图1C和1D所示,整个电极的外径约为40μm,CFdisk电极的直径约为7μm,纳米Auring的厚度约为350 nm。此外,在挑选的毛细管玻璃壁厚度和拉制仪温度下,CFdisk和Auring电极之间玻璃管的厚度约为10μm。
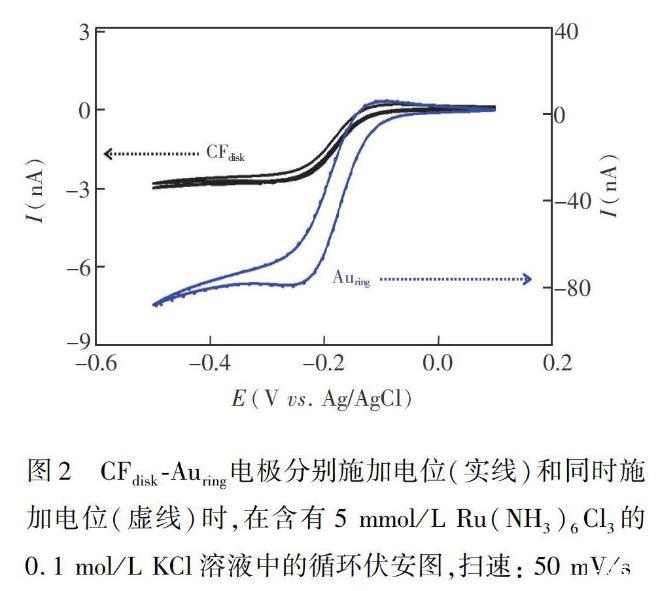
图2为环盘电极、CFdisk电极和Auring电极在5 mmol/LRu(NH3)6Cl3溶液中的循环伏安图。如图2实线所示,在0.5~+0.1 V的电位范围内,环盘电极中的CFdisk和Auring电极单独施加电位时,两个电极的循环伏安图为典型的稳态伏安曲线,
说明CFdisk和Auring均具有微电极的特征。为了考察CFdiskAuring电极中CFdisk电极和Auring电极之间是否存在扩散层交盖,并且可独立工作,使用两通道,将CFdiskAuring环盘电极中的两个电极同时施加电位,如图2虚线所示,CFdisk和Auring的循环伏安图也为稳态曲线,并且两个电极的电流大小和分别施加电位的图相同,说明两个电极之间未扩散层交盖。上述研究结果说明,此电极可用于两组分的同时检测。
3.2环盘电极对H2O2和DA的电化学响应
如前所述,利用Auring电极检测电刺激DA的释放,并通过电化学沉积的方法,将对H2O2有选择性催化的PB沉积在中间CFdisk电极上。H2O2虽然具有电化学活性,但是在一般电极上氧化还原过电位很大,氧化电位高于+0.6 V,还原电位低于
0.5 V,而PB在中性溶液中容易结构坍塌,因此用电聚合的方法将导电聚合物PEDOT原位聚合在PB/CFdisk电极上,用以保持PB在中性溶液的稳定性。图3为所制备的电极对H2O2和DA在中性溶液中的电化学响应图。PB/CFdisk电极修饰PEDOT前后循环扫描25圈的稳定性图如图3A和图3B所示,PB/CFdisk电极在+0.18 V有一对可逆的PB的氧化还原峰,氧化还原峰电流在循环扫描的过程中,因为PB在中性溶液中不稳定,电流逐渐减小,而经过PEDOT保护的PB/CFdisk电极,PB的氧化还原峰电流并未明显的降低,说明PEDOT对PB具有很好的保护作用。当在中性PBS中加入300μmol/L H2O2时,PB的氧化峰电流减小,还原峰电流增加(图3C),说明PB对H2O2具有良好的催化作用。DA在Auring电极上的电化学行为(图3D)表明,DA在+0.18 V处氧化电流到达稳态,说明DA在Auring电极上有很好的电化学响应。
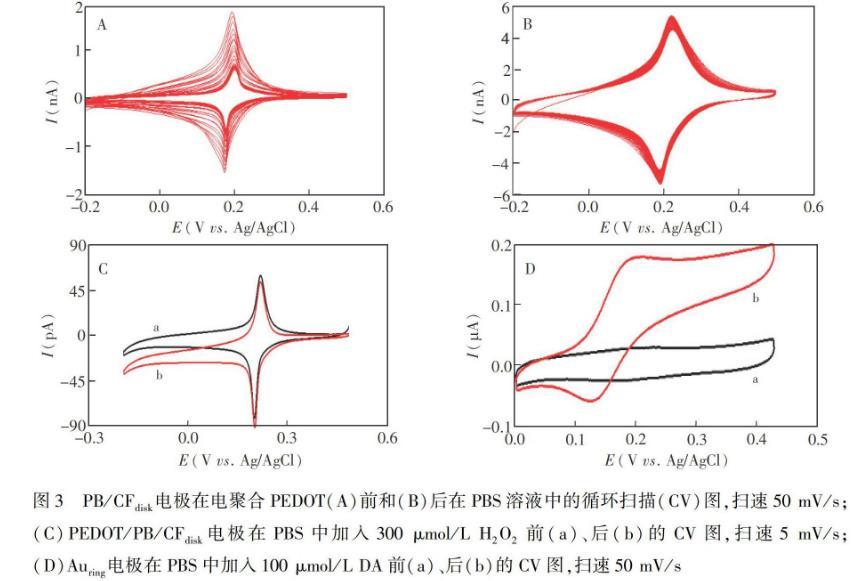
图3 PB/CFdisk电极在电聚合PEDOT(A)前和(B)后在PBS溶液中的循环扫描(CV)图,扫速50 mV/s;(C)PEDOT/PB/CFdisk电极在PBS中加入300μmol/L H2O2前(a)、后(b)的CV图,扫速5 mV/s;(D)Auring电极在PBS中加入100μmol/L DA前(a)、后(b)的CV图,扫速50 mV/s
3.3环盘电极对H2O2和DA的电化学分析
为了避免环盘电极上H2O2和DA的相互干扰,本研究选择PEDOT/PB/CFdisk电极对H2O2的检测电位为0.05 V。首先考察了PEDOT/PB/CFdisk电极和Auring电极对H2O2和DA检测的线性和灵敏度,结果如图4所示。由图4A可见,在0.05 V电位下,在PBS溶液中连续加入一定浓度的H2O2时,PEDOT/PB/CFdisk电极具有良好的电流响应,H2O2浓度在1~29μmol/L范围内,电流响应与浓度呈现良好的线性关系(I(pA)=27.67-4.37CH2O2(μmol/L),R=0.98),检出限为0.4μmol/L(S/N=3)。Auring电极对DA也具有良好的响应,DA浓度在0.5~25μmol/L,其电流响应值与DA浓度呈良好的线性关系(I(nA)=0.40(nA)+0.45CDA(μmol/L),R=0.99),检出限为0.18μmol/L(S/N=3)。
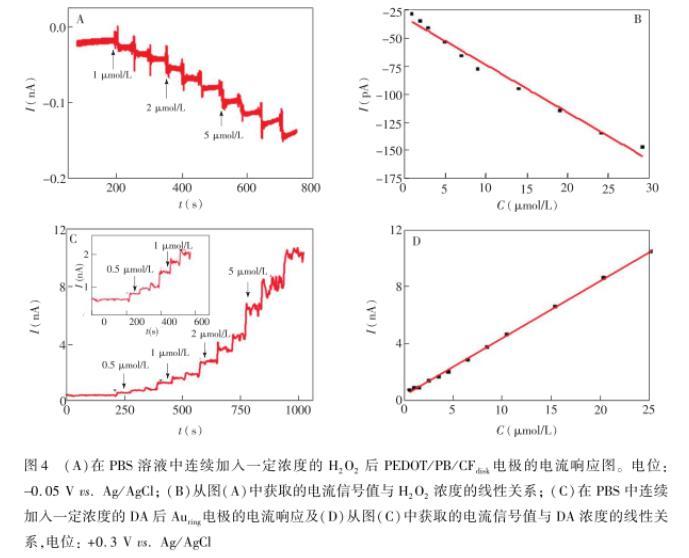
进一步考察了环盘电极之间是否存在交叉干扰,结果如图5所示,当PBS溶液中加入20μmol/L H2O2后,Auring电极上未出现明显的电流变化,而PEDOT/PB/CFdisk电极上的电流则明显下降。加入图4(A)在PBS溶液中连续加入一定浓度的H2O2后PEDOT/PB/CFdisk电极的电流响应图。电位:0.05 Vvs.Ag/AgCl;(B)從图(A)中获取的电流信号值与H2O2浓度的线性关系;(C)在PBS中连续加入一定浓度的DA后Auring电极的电流响应及(D)从图(C)中获取的电流信号值与DA浓度的线性关系,电位:+0.3 V vs.Ag/AgClDA后,Au ring电极的电流出现了明显增加,而PEDOT/PB/CFdisk电极的电流未明显变化。
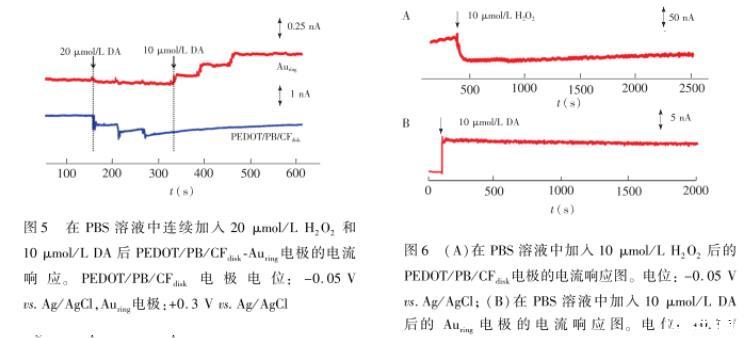
这些结果表明,PEDOT/PB/CFdiskAuring电极两个通道之间未交叉干扰,因此可用于MFB NAc脑区中H2O2和DA的同时检测。
利用计时电流法检测时,电极的稳定性也是活体分析要考虑的重点问题。如图6A所示,在2000 s内,PEDOT/PB/CFdisk电极能保持良好的稳定性。本研究采用溅射成膜方式形成的Auring电极,检测DA在2000 s内同样拥有良好的稳定性,这与文献[30]报道的金电极对DA检测具有良好的稳定性一致。
3.4鼠脑内的H2O2和DA的活体检测
为了证明Auring电极能够用于实时监测活体内DA的变化,将环盘电极植入到SD大鼠的NAc脑图6(A)在PBS溶液中加入10μmol/L H2O2后的PEDOT/PB/CFdisk电极的电流响应图。电位:-0.05 V vs.Ag/AgCl;(B)在PBS溶液中加入10μmol/L DA后的Auring电极的电流响应图。电位:+0.3 Vvs.Ag/AgCl区,并在MFB区域用双极电极进行电刺激(60 Hz,±300μA,3 s)。如图7A所示,在刺激后,Auring电极上记录到短暂的脉冲式电流变化,
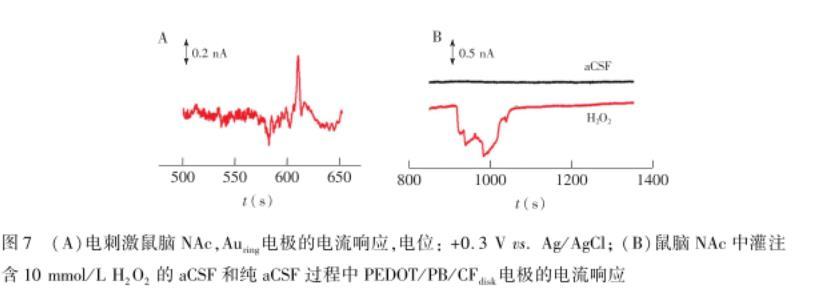
这种释放模式与文献报道一致。但是,在刺激下未观察到H2O2浓度变化。为了考察PB/PEDOT/CFdisk电极能对H2O2具有响应,利用微灌注的方式,在微电极附近灌注H2O2(10 mmol/L),结果如图7B所示,灌注H2O2 100 s后,电流逐渐下降,并达到峰值;停止灌注后,电流又恢复到基线值,说明PB/PEDOT/CFdisk电极对在活体内对H2O2也具有良好的响应。
4结论
制备了用于H2O2和DA检测的环盘微电极,此电极对H2O2和DA均有良好的电流响应和稳定性。PEDOT/PB/CFdisk电极和Auring电极之间未交叉干扰,可检测活体内H2O2和DA浓度的变化。虽然在电刺激的过程中未观察到二者浓度同时变化,但此方法可用于其它的生理或者病理过程中有关H2O2和DA浓度的变化,并促进与之相关的生理和病理的研究。
 相关新闻
相关新闻