热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
研究简介:本论文绍了一种创新的微针微引擎深度给药技术,该技术通过使用活体微生物——产气肠杆菌(Enterobacter aerogenes)作为微引擎,主动控制药物传递至皮肤深层。研究者开发的气动微针贴片能够通过调整葡萄糖浓度精确控制药物的深度和扩散范围,显著提高了药物传递的深度,超过传统微针技术的200%,能够达到皮下1000微米。研究指出,传统的微针给药主要依赖于被动扩散,这限制了药物的穿透深度和扩散范围。而这种新型微针技术通过微生物产生的气体作为推动力,驱动药物深入组织,解决了这一难题。在银屑病动物模型中,该技术有效地将钙三醇传递到皮下组织,快速缓解了症状。本研究提到了微生物产生的气体成分——氢气(H2),它具有抗氧化和抗炎特性,可能对治疗银屑病等免疫介导疾病具有潜在的辅助治疗效果。这一发现为微针技术提供了新的治疗途径,不仅提高了药物传递的效率,还可能通过气体的生物学效应增强治疗效果。这项研究通过结合微生物工程和微针技术,为经皮给药领域带来了一种新的可控药物传递平台,具有提高药物生物利用度、减少给药剂量和频率、以及增强治疗效果的潜力。这一创新技术有望在多种疾病的治疗中得到应用,特别是在需要深层组织药物传递的情况下。
Unisense氢气微电极系统的应用
Unisense微电极系统被用来精确测量微生物微针微引擎(MM-MNs)产生的气体,特别是氢气(H2)的浓度和产生速率。该系统能够在模拟的体液中对单个微针进行检测,通过H2电极探针来定量评估MM-MNs的气体产生情况。通过准备不同浓度葡萄糖的微生物微针,以调整和控制气体产生的持续时间和总量。当微针装载有30 mg/mL的葡萄糖时,显示出最显著的气体产生持续时间和量。Unisense微电极系统还被用于监测不同皮肤深度下皮下气体浓度的实时变化。通过将MM-MNs插入不同厚度的猪皮中,研究者们能够测量透过皮肤在模拟体液中的气体浓度,从而反映了MM-MNs的气体渗透能力。相关实验数据显示,即使在5毫米厚的猪皮中,气体的渗透能力仍然显著,表明由MM-MNs产生的气体可以有效地穿透皮肤真皮层,为药物传递提供了动力来源。
实验结果
研究提出了一种具有可调推进力的活体微针微引擎系统,利用内部加载的产气微生物实现气体动力学的驱动。这种系统显著增强了微针在皮肤下的药物溶解与释放能力,提高了透皮给药的深度和扩散效率。所开发的微针基质由PEGDA制成,包裹肠杆菌(E.A.),展现出超越传统金属基材的优越特性。微生物的持续气体产生可施加超过0.04 N的推动力,使药物深度可达1000μm,较传统微针提高200%以上的输送效率。此外,微针中微生物的隔离设计有效防止了组织损伤,保证了生物相容性。在牛皮癣小鼠模型中,该系统通过输送卡泊三醇显著改善了症状,显示出其在治疗深层组织病变方面的潜力。气体在皮肤微环境中的扩散和压力分布是药物输送的关键因素。实验发现,气体在皮肤中的扩散表现出显著的横向和纵向特性,形成的局部高压环境有助于药物向深层扩散。通过调节微针中葡萄糖浓度,可以控制气体的释放速度和药物的扩散范围。未来研究应着重于微针孔中气体扩散的物理模型及其对药物输送的影响,尤其是高分子量药物的传输效率。此外,探索不同类型的微生物及其气体成分的潜在疗效,将进一步拓展该技术的应用范围。通过设计环境响应的活微生物气动微针,结合疾病特异性因素,进一步增强其药物释放的可控性和效率,从而提供一种创新的药物输送策略。
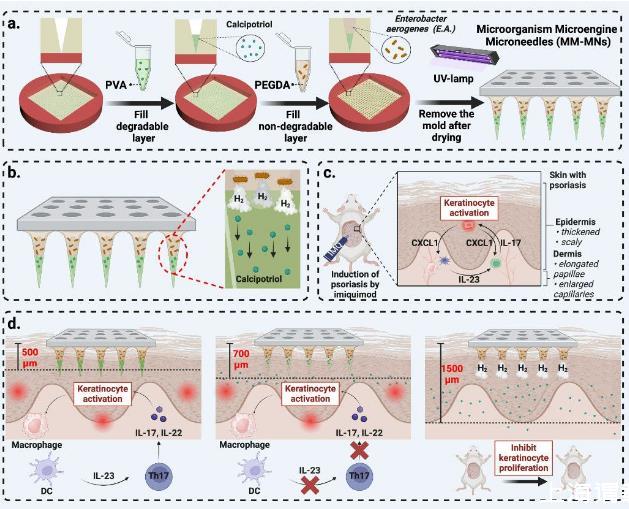
图1、微生物微引擎微针(MM-MNs)的制备、应用原理及工艺。a)双层微生物辅助气体动力微针的制备工艺。b)产气肠杆菌(EA)推动药物从可分离层中释放。c)银屑病的发病机制。d)微生物辅助气体动力微针推动卡泊三醇在银屑病治疗中释放深部组织的机制。
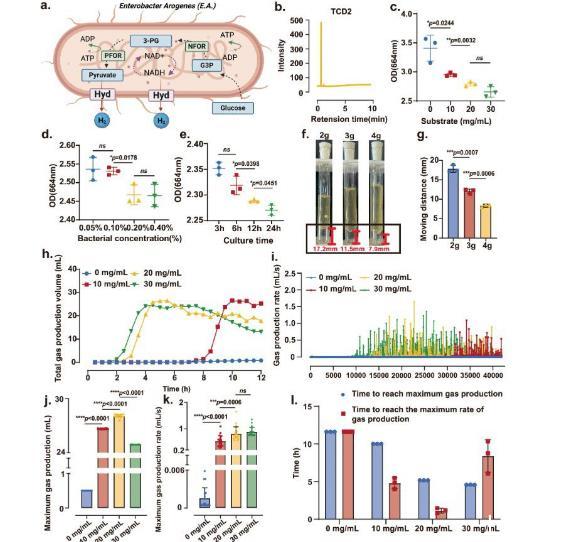
图2、微生物有可能成为空气动力的来源。a)一个E.A.分解底物葡萄糖产生H 2。使用BioRender.com/l25i234创建。b)EA产生的混合气体的气相色谱检测结果。c–e不同接种水平(c)、底物浓度(d)和培养时间(e)下微生物产H 2的变化。n=3个独立样本的平均值±SD。双面学生t检验。f不同质量的琼脂块被EA产生的气体推动的实验图。g)EA的效果。在不同质量的琼脂位移距离上产生气体。n=3个独立样本的平均值±SD。双面学生t检验。h)不同底物浓度下气体产量随时间的变化。i)不同底物浓度下气体生产率随时间的变化。j)不同底物浓度下最大产气量的变化。k)不同底物浓度下最大产气速率的变化。n=20个独立样本的平均值±SD。双面学生t检验。l)达到最大产气量和产气率的时间。
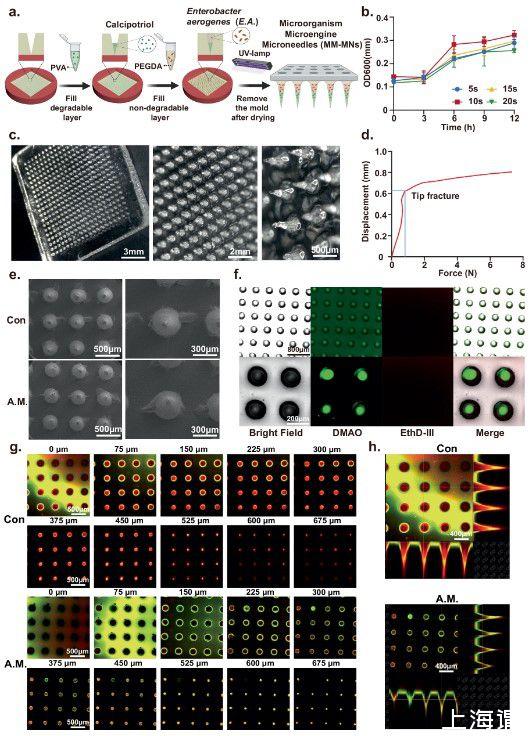
图3、微生物微引擎微针(MM-MNs)的制备及细菌活性验证。a)MM-MNs的制备过程。使用BioRender.com/e35z291创建。b)紫外线照射时间对EA活性的影响..n=3个独立样品的平均值±SD。c)微针形态的数字显微镜表征。比例尺,3毫米(左);2毫米(中);500微米(右)。d)微针尖端断裂的机械力。e)微针形态的扫描电子显微镜表征。比例尺,500μm(左);300微米(右)。f EA的荧光显微镜结果。封装在微针中的活性。比例尺,800μm(向上);200微米(下)。g,h EA的共焦显微镜结果。封装在微针中的活性。比例尺,500μm(g);比例尺,400μm(h)。c、e、f、g和h显示了每组四个生物独立样本的代表性图像。
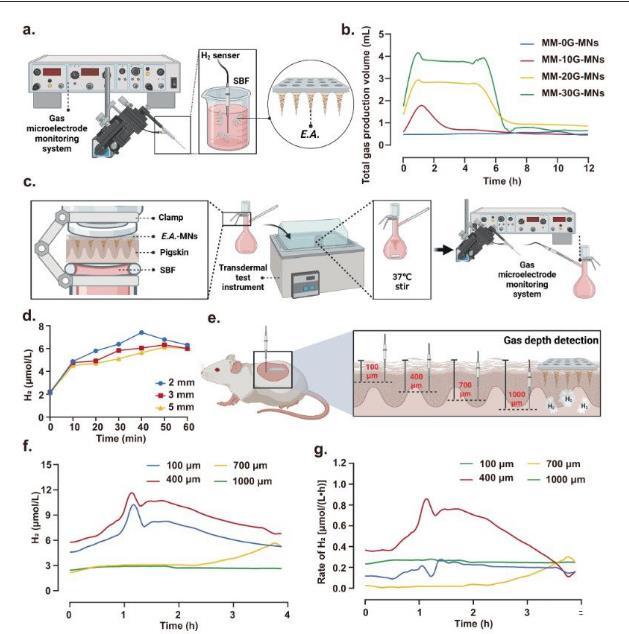
图4、微生物微引擎微针(MM-MN)的气体穿透深度表征。说明使用unisense微电极系统检测模拟体液中MM-MN的气体产生。使用BioRender.com/e13d275创建。b)当浸入模拟体液时,负载不同浓度葡萄糖的单微针释放气体。c)使用透皮测试仪测试MM-MNs对不同皮肤厚度的渗透性的测试图。使用BioRender.com/e13d275创建。d模拟体液中氢气穿透不同厚度猪皮后随时间的变化趋势。n=3个独立样本的平均值±SD。e)使用unisense微电极实时监测不同深度皮下气体浓度实验图。f,g)皮肤内氢气浓度(f)和气体产生速率(g)随着时间的推移的趋势。
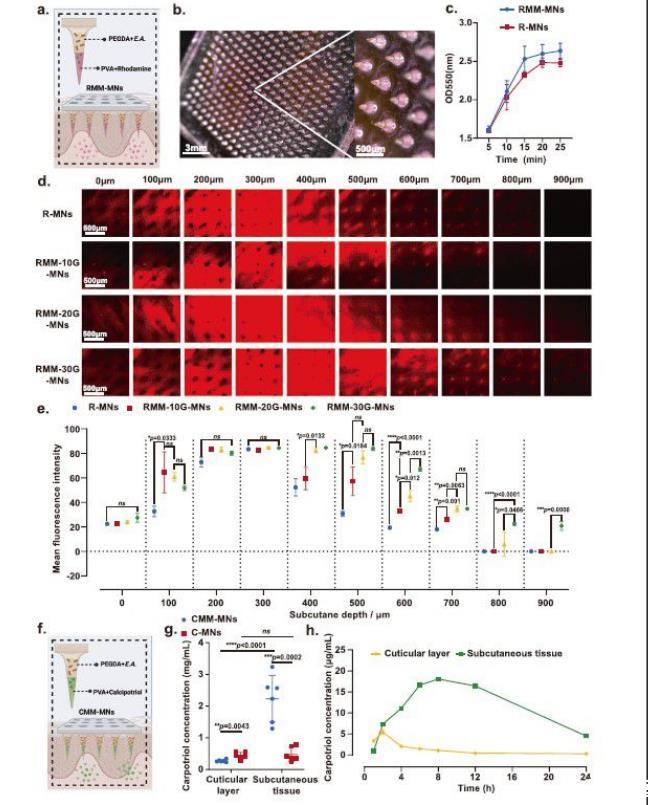
图5、微生物微引擎微针(MM-MN)的药物递送性能表征。a)双层微针,外层载有罗丹明染料,内层含有载有EA的聚乙二醇二丙烯酸酯(PEGDA)。使用BioRender.com/e13d275创建。b)RMM-MNS的数字显微镜图像。比例尺,3毫米(左);500微米(右)。c)模拟体液中罗丹明随时间的释放。n=3个独立样本的平均值±SD。d)负载不同浓度葡萄糖的微针释放的罗丹明染料进入皮肤的渗透深度的共聚焦显微镜成像。比例尺,500μm。e)负载不同浓度葡萄糖的微针释放的罗丹明染料在皮下不同深度扩散的荧光强度。n=3个独立样本的平均值±SD。双面学生t检验。f)双层微针,外层载有卡泊三醇,内层含有载有EA的PEGDA。使用BioRender.com/e13d275创建。g)采用高效液相色谱法(HPLC)测定皮肤表面和皮下组织中卡泊三醇的浓度。n=6个独立样本的平均值±SD。双面学生t检验。h)通过HPLC测定皮肤表面和皮下组织中己三醇浓度随时间的变化。n=6个独立样本的平均值±SD。(b)和(d)中显示了每组四个生物学独立样本的代表性图像。
结论与展望
作为一种透皮给药方法,微针具有微创、无痛、精准的原位治疗。然而目前的微针依赖于被动扩散,导致药物渗透不可控。为了克服这个问题,研究人员开发了一种气动微针贴片,它使用活产气肠杆菌作为微引擎来主动控制药物输送。这些微生物产生气体,将药物驱动到更深的组织中,并且可调节葡萄糖浓度,从而可以精确控制该过程。Unisense微电极系统被用来精确测量微生物微针微引擎(MM-MNs)产生的气体,特别是氢气(H2)的浓度和产生速率以及监测不同皮肤深度下皮下气体浓度的实时变化。通过将MM-MNs插入不同厚度的猪皮中,研究者们能够测量透过皮肤在模拟体液中的气体浓度,从而反映了MM-MNs的气体渗透能力。研究结果表明,这种微生物驱动的系统将药物输送深度增加了200%以上,达到皮下1000μm。在牛皮癣动物模型中,该技术有效地将骨化三醇输送到皮下组织中,从而快速缓解症状。这项创新解决了传统微针的局限性,提高了药物效率、透皮渗透性,并引入了按需控制药物输送的创新范例。本研究的意义在于提供了一种创新的药物递送策略,通过利用微生物的自然产气机制与微针技术相结合,实现了对药物递送深度的精确控制。这种策略不仅提高了药物的透皮给药效率,还减少了所需的药物剂量和潜在副作用,尤其在需要快速缓解症状的情况下显示出其独特的优势。此外,这种微针系统的生物相容性和隔离设计有效防止了组织损伤,保证了治疗的安全性。这项技术为深层组织病变的治疗提供了新的可能性,并为未来药物递送系统的发展开辟了新的方向,尤其是在高分子量药物的传输效率和疾病特异性因素的结合上,具有极大的潜力和应用前景。