热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
反硝化厌氧甲烷氧化(DAMO)过程可以在厌氧条件下同步实现脱氮和CH4减排。该过程是一种独特的反硝化反应,当硝酸盐或亚硝酸盐作为电子受体被还原为N2的同时,CH4作为唯一电子供体被氧化为CO.研究表明,DAMO过程对海洋沉积物中CH4的消耗减排占据了主导地位,且在湿地、河流、深水湖泊等自然生境以及农业土壤和废水中均存在,该过程在全球碳氮循环的过程中起关键作用。DAMO微生物最早在淡水沉积物培养物中富集而得,起主导作用的功能微生物可以分为两大类:NC10门细菌的Candidatus‘Methylomirabilis oxyfera’(M.oxyfera)和隶属于ANME(anaerobic methanotrophic archaea,厌氧甲烷氧化古菌)中的一个簇ANME-2d的Candidatus‘Methanoperedens nitroreducens’(M.nitroreducens)。其中,DAMO古菌通常被认为只能将硝酸盐(NO3-)还原为亚硝酸盐(NO2-),因此需要与其他微生物协同作用以达到理想的脱氮效果。目前的研究表明,DAMO古菌可以与DAMO细菌协同进一步将NO2-还原为N2;同时,也已有研究发现在污水处理厂中DAMO微生物与厌氧氨氧化(Anammox)细菌共存现象,因此可以共培养DAMO古菌与Anammox细菌形成耦合系统,通过Anammox细菌进一步利用DAMO古菌产生的NO2-作为电子受体、污水中的NH4+作为电子供体产生N2,从而实现总氮的高效去除和温室气体的减量排放。
将硝酸盐型~DAMO与厌氧氨氧化联合应用,能够在两类优势菌种的协同作用下将各种形式的氮转化为N2,同时实现总氮去除和CH4减排。然而,在对Anammox-DAMO耦合系统的研究过程中检测到了N2O,这说明并不是所有的氮都能转化为N2被去除,而是在脱氮过程中生成了N2O这一中间产物。迄今为止的研究结果没有证据表明厌氧氨氧化细菌在正常代谢过程中会产生N2O1-1.N2O作为反硝化过程的中间产物,一般认为在DAMO过程不会出现,这是因为DAMO微生物的代谢途径特殊,DAMO细菌利用NO歧化酶将NO转化为N2和O2,产生的O2再对CH4进行氧化,略过了中间体N2O的生成。虽然DAMO微生物中存在编码N2O生成及降解的基因,但相关研究的实验结果表明DAMO系统中有少量N2O的产生,然而降解N2O的基因却未能表达。目前关于废水处理过程中N2O产生的研究大多集中在传统反硝化工艺,鲜少有人将研究聚焦于DAMO、Anammox等新型脱氮技术。
温度变化会影响与N2O产消相关的微生物及酶的活性,从而引起N2O积累量的波动。有研究者利用A/O SBR反应器探究N2O随温度变化的产消情况,发现在15℃的低温条件下N2O排放量比25℃时增加了1.9倍。Anammox与DAMO耦合脱氮过程中N代谢途径较为复杂,不同温度影响下该系统N2O的产消规律如何变化还有待探究。目前关于污水脱氮工艺中N2O排放的研究多集中在中低温条件,然而在某些特定的气候条件下高温也会显著影响废水处理效果。本文以Anammox-DAMO系统为研究对象,探究中、高温影响下该系统的性能与N2O产消变化规律,通过分子生物学手段及动力学机制探明N2O产消的代谢途径,并提出N2O减排策略。
1材料与方法
1.1试验装置
批次试验使用内径7.0cm、高14.0cm,有效容积为250mL的厌氧子反应器(图1);连续试验使用内径16cm、高30cm、容积为3.5L的厌氧母反应器。反应器所有取样口均设有阀门,阀门关闭时,反应器呈全封闭状态,维持反应器内厌氧状态,整个反应过程中使用磁力搅拌器进行连续搅拌,保证反应器内泥水混合均匀。
图1试验装置
1.2接种污泥与营养液
试验系统为以Anammox菌和DAMO古菌为优势菌种的Anammox-DAMO系统,以西湖底泥、杭州西溪河底泥与农田水稻土壤的混合污泥为接种物,在厌氧条件下供给CH4、NO3-和NH4+,试验期间系统运行稳定。
营养液新鲜配制,使用前氮吹30min以排除O2,组成如下:KH2PO40.05g/L;CaCl2·2H2O 0.3g/L;MgSO4·7H2O 0.2g/L;NaHCO31.05g/L;微量元素含量为1.25mL/L.微量元素包括(g/L):15 EDTA,0.43 ZnSO4·7H2O,0.24 CoCl2·6H2O,0.99 MnCl2·4H2O,0.25 CuSO4,0.22(NH4)6MoO24·4H2O,0.19 NiCl2·6H2O,0.067 SeO4,0.014 H3BO3,0.05 Na2WO4·2H2O.营养液以去离子水为溶剂配制。
1.3试验方法
1.3.1批次试验为了研究温度对系统的短期影响,并建立温度影响下N2O产消动力学模型,进行为期10d的批次试验。从母反应器中各取200mL泥水混合液注入厌氧子反应器中,各子反应器的NO3-和NH4+起始浓度为20mg/L,CH4浓度为80mg/L,pH=7.0,试验温度分别设置为20,25,30,35,40℃,每组设3个平行。试验期间,每24h取气样3.0mL,水样3.0mL,经0.22µm微孔滤膜过滤后测定NO3--N、NO2--N及NH4+-N浓度,同时监测系统中CH4含量以及N2O浓度变化。
1.3.2连续试验基于批次试验结果,筛选出反应效率最优以及N2O积累量最多的两组具有代表性的温度条件进行连续试验,以揭示温度对Anammox-DAMO系统的长期影响。以DAMO微生物倍增周期25d为一个实验周期进行3个周期实验,保持各系统pH值为7.0——7.2.每48h取各反应器水样5.0mL,气样4.0mL,利用紫外分光光度计和气相色谱仪分别测定NO3--N、NO2--N、NH4+-N、CH4、N2O的含量。以7d为一个加药周期,每7d补充一次NO3-、NO2-、CH4.在试验前中后期分别取泥水混合物30mL,热提法提取EPS提取液后测量含蛋白质(PNs)和多糖(PSs)的胞外聚合物(EPSs)的组成以及浓度变化。在连续试验前、中、后期分别取5mL污泥样品进行高通量测序分析。
1.4分析方法
NO3--N、NO2--N和NH4+-N浓度使用双束紫外~可见分光光度计(TU1901)按照标准方法测量。使用气相色谱仪(GC2030,岛津)测量顶空N2O含量以及CH4含量。采用pH计(梅特勒FG2)监测反应器内pH值的变化。采用热提法分离EPS.PNs和PSs的测定方法分别为福林酚试剂法和蒽酮法。通过Usearch软件和Gold数据库将剩余序列聚集到操作分类单元(OTU)中。利用E.Z.N.A.®土壤DNA试剂盒(Omega Bio-tek,美国)进行样品DNA抽提进行后续宏基因组测序。Illumina NovaSeq测序平台用于宏基因组测序。
1.5动力学模型
采用酶动力学方程模拟NO3-、NH4+的还原以及N2O的产生和还原,如式(1)所示。

式中:RER为酶活性函数;Vmax,R为相应还原酶反应的最大比合成/活化速率,d-1;KE,i为酶诱导的半饱和常数,mg/L;KI,R为相应还原酶抑制系数,mg/L;Ci为底物的水相浓度,mg/L;R为还原酶(即Nar、Nir、Nos);i为相应底物(即NO3-、NH4+、N2O);CT为温度变化因素。
2结果与讨论
2.1温度对Anammox-DAMO系统性能及N2O产消的影响
2.1.1温度对Anammox-DAMO系统性能的影响根据厌氧氨氧化微生物和DAMO微生物的最适生长温度条件4-2,选择20——40℃进行短期试验,对试验结果进行单因素方差分析。从图2可见,NO3-、NH4+、CH4的降解速率均随温度的升高先增大后减小,而N2O的浓度峰值整体呈现先下降后上升的趋势。系统在温度为40℃时,N2O的浓度峰值达到最大。对温度影响下的批次实验结果进行单因素方差分析,发现40℃温度条件对N2O排放量的影响最大,另外对各环境因素进行正交实验,结果显示30℃为该系统脱氮性能最优的温度条件,因此将30℃作为对照组,40℃作为实验组进行长期试验研究,以探明不同温度条件下Anammox-DAMO系统性能及N2O产消规律。
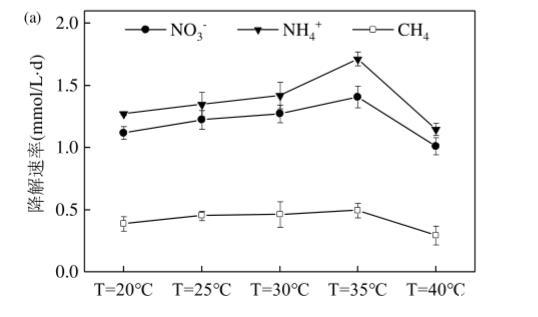
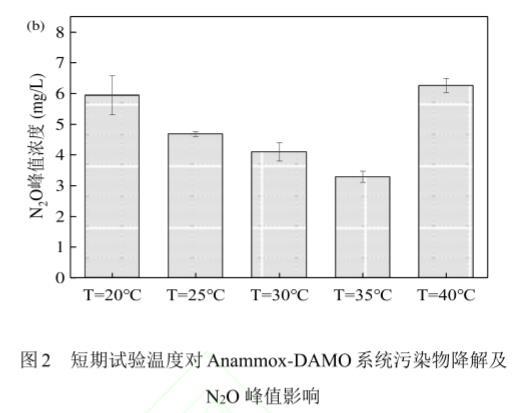
图2短期试验温度对Anammox-DAMO系统污染物降解及N2O峰值影响
图3(a)和图3(b)表明,Anammox-DAMO系统在40℃高温条件下的脱氮性能要低于30℃,但随着时间的推移,R2系统的脱氮性能较前期有提升,这说明该体系可以逐渐适应高温的胁迫,这主要归因于微生物会在极端环境下产生特殊的蛋白质和酶来帮助细胞抵御胁迫。有研究表明,瞬时高温冲击会对Anammox菌的活性产生抑制作用,但长期运行下系统的性能逐渐恢复,这说明Anammox菌具有缓解高温抑制的内部机制。R2系统受到高温的影响,在反应过程中出现了亚硝酸盐的积累,平均积累浓度为(1.43±0.47)mg/L.从图3(c)可知,R2系统中的硝酸盐、氨氮、CH4降解速率均低于R1系统,说明高温对系统中微生物活性产生了抑制作用,影响了其正常代谢。有研究表明,Anammox活性(SAA)会随着温度的升高呈现先升高再降低的趋势,温度对Anammox菌群蛋白质变化情况的影响也说明了Anammox菌的活性在高温下受到抑制。有研究探究了温度对Anammox-DAMO共培养系统的影响,结果表明温度对耦合系统的影响同样呈先上升后下降的趋势,在高温下微生物活性降低8-3.
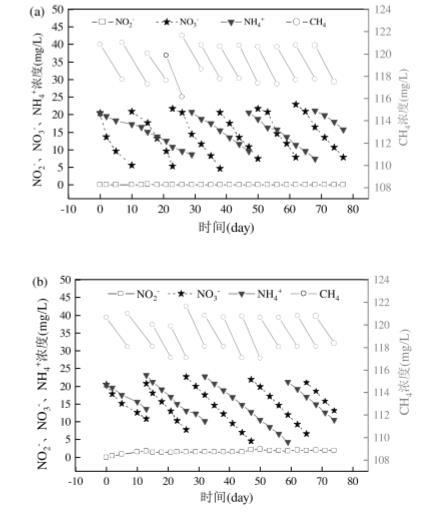
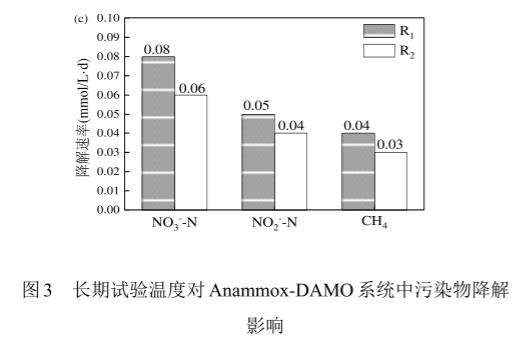
图3长期试验温度对Anammox-DAMO系统中污染物降解影响
在两个系统的长期运行过程中均检测到了硝酸盐异化还原为铵(DNRA)反应,DNRA是一个特殊的生物反应过程,使用亚硝酸盐作为中间物将硝酸盐还原成铵1-3.在R1系统中,硝酸盐降解速率为0.08mmol/(L·d),氨氮降解速率为0.05mmol/(L·d),CH4降解速率为0.04mmol/(L·d),CH4降解速率与硝酸盐降解速率实际比值(1:2.00)与DNRA反应的理论比值(1:2.10)相符,说明在R1系统中同时存在DAMO、Anammmox、DNRA反应。R2系统中硝酸盐降解速率为0.06mmol/(L·d),氨氮降解速率为0.04mmol/(L·d),CH4降解速率为0.03mmol/(L·d),也观察到了相同的结果,证明了DAMO、Anammmox、DNRA反应的共存。
2.1.2温度对Anammox-DAMO系统N2O产消的影响由图4可知,2个系统均观察到了明显的N2O产消,且R2系统中N2O的总体累积量大于R1系统,其中R1系统N2O平均峰值浓度为(4.86±0.30)mg/L,R2系统为(6.85±0.59)mg/L.
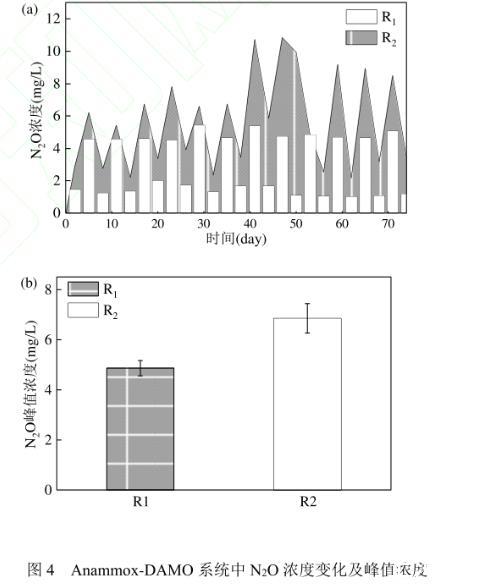
相比于R1系统,R2系统产生了更多的N2O,研究表明,在N-DAMO系统中,nrfA的转录水平随亚硝酸盐浓度的增加而显著上调,推测在R2系统中DAMO古菌为了应对亚硝酸盐的胁迫加剧了DNRA反应的发生。在高浓度亚硝酸盐影响下DNRA过程会生成NO,出于对NO的解毒作用,DNRA将NO转化为N2O.Pereira在研究操作条件对厌氧氨氧化系统N2O产生的影响过程中发现亚硝酸盐是N2O生成和积累的关键,这主要归因于AOB中由细胞色素P460(CytL)催化的厌氧羟胺(NH2OH)解毒途径。Ding等也发现N2O释放率与亚硝酸盐浓度呈正相关,这是因为亚硝酸盐和N2O会竞争电子,当用于亚硝酸盐还原的电子通量高于用于N2O还原的电子通量时,N2O就会积累。同时,在亚硝酸盐和硝酸盐共存的情况下,亚硝酸盐和硝酸盐还原酶之间对电子供体的竞争也可能导致N2O的不完全还原。另外,由于受到高温影响,Anammmox细菌活性受到抑制,易造成中间产物NO的积累,为了防止NO对微生物造成毒害作用,Anammox细菌将NO转化为N2O,因此在R2系统中产生更多的N2O。