热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
研究团队开发了一种高度柔性的神经袖套,结合了电化学驱动的导电聚合物软致动器与低阻抗微电极。这种设计能够在仅需几百毫伏的应用电压下实现主动抓握或环绕精细神经的能力。通过大鼠模型进行的体内验证显示,这些神经袖套可以形成并维持一个自我封闭且可靠的生物电子接口与坐骨神经相连而无需使用外科缝合线或粘合剂。研究中还探讨了不同厚度的导电聚合物聚吡咯(PPy)层对致动性能的影响,发现厚度的变化能够影响弯曲幅度和响应时间。此外,研究证明了该装置在重复操作下的稳定性和可靠性,并通过细胞毒性实验确保了其生物相容性。其具有潜在的应用于治疗慢性神经痛、运动障碍、代谢性疾病以及假肢肢体闭环控制的可能性。
研究亮点
1.开发了结合电化学驱动的导电聚合物软致动器与低阻抗微电极阵列的高度柔性的神经袖套,只需几百毫伏的电压即可控制袖套的弯曲幅度和方向。2.掺杂十二烷基苯磺酸盐(PPy(DBS))的聚吡咯作为驱动材料,以达到需要的体积变化。
研究背景
传统的周围神经接口通常需要复杂的植入手术,这些手术可能带来较高的神经损伤风险。因此,研究人员致力于开发一种微创的神经接口系统,以减轻这些风险。周围神经接口在生物电子医学中扮演着越来越重要的角色,已经被用于治疗慢性神经痛、运动障碍、代谢性疾病等。
研究内容
研究者介绍了一种软机器人薄膜生物电子周围神经袖带,它集成了数十个分布式高分辨率微电极和基于导电聚合物的双层致动器,可以通过可编程电输入进行控制。研究者选择了掺杂十二烷基苯磺酸盐(PPy(DBS))的聚吡咯作为驱动材料,因为它在电化学刺激下会发生巨大的体积变化。当施加轻微的负电压时,由于溶剂化阳离子(例如Na+)被拉入聚合物基质中,聚合物会发生体积膨胀。相反,正电压会导致阳离子被驱逐回电解质,从而导致聚合物收缩。通过利用这种可逆电化学过程,由PPy(DBS)涂覆的金(Au)形成的双层结构表现出可控的弯曲行为。
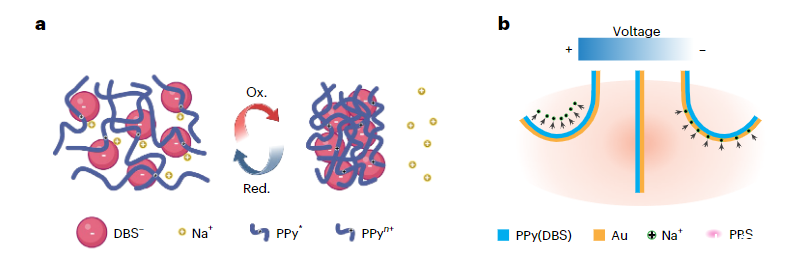
图1:a.电化学过程中PPy(DBS)因Na+等小阳离子的传输而引起的巨大体积变化。b.PPy(DBS)/Au双层致动器在PBS溶液中垂直于薄膜表面来回的可逆弯曲运动。
通过在0.1 M NaDBS/0.1 M吡咯溶液中施加2 mA cm-2的恒定电流,研究者们以电化学方式将PPy(DBS)沉积在Au涂覆的聚对二甲苯C(PaC)薄膜上。在薄膜沉积过程中,带负电的大体积阴离子DBS-被纳入聚合物基质中,以保持整体电荷中性。
总体而言,薄膜厚度随着沉积电荷量线性增加,每C cm-2增加约6.7μm。随着薄膜变厚,它往往变得越来越不均匀,受到压实密度增加。研究者们通过在0.1 M NaDBS中以10 mV s-1进行循环伏安法(CV)扫描来预处理薄膜,以完全激活PPy(DBS)。最初,该装置是平坦的,但经过几次CV扫描后,它转变为卷曲状态,并伴随着不可逆电流,在第一个周期中尤其明显。即使在没有任何施加电压的情况下,预处理最终也会导致完全卷曲的状态。较高的频率涉及参与反应的阳离子较少,因此导致弯曲幅度逐渐减小。这种现象与阳离子移动穿过聚合物基质所需的时间有关。具有不同PPy(DBS)厚度的器件的性能表现出一致的趋势。一般来说,弯曲幅度随着转移电荷量的增加而增加,并且高度依赖于PPy(DBS)的厚度。
研究者验证了袖带在体外自动包裹神经的能力,将绝缘线作为坐骨神经模型,浸入PBS溶液中并放置在琼脂糖凝胶上。导线和凝胶之间保持一个小间隙,允许装置通过。在逐步施加从-0.4到0.4 V的电压时,该装置慢慢地缠绕在模型上并逐渐收紧,直到形成牢固的抓握,并在施加-0.4 V的电压时释放。
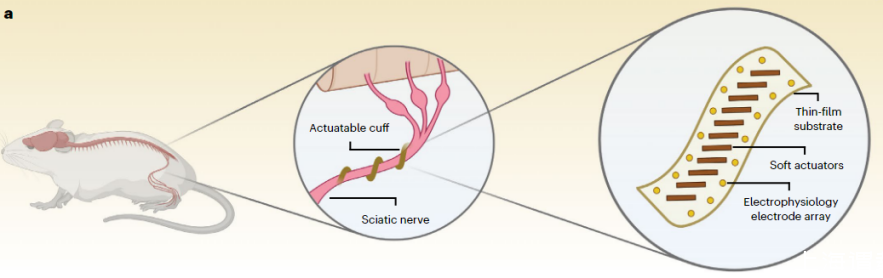
图2:软执行器集成神经袖带电极和柔性神经套囊主动包裹坐骨神经以实现无需缝合的亲密界面的概念示意图。
研究前景
研究者们将继续探索如何通过优化材料和设计来提高电极阵列的性能,例如通过改进导电聚合物的性能,使袖套能够更好地适应神经的形状和尺寸。同时利用传统的微制造技术,可以进一步完善薄膜设备的设计,集成精确图案化的致动元件和微电极阵列,实现更低电压驱动下的形状变换。未来的研究可能会更多地采用有限元分析来深入理解不同设计因素之间的相互作用,以及它们如何影响螺旋致动行为,特别是极端弯曲条件下的表现。另外,尽管已经进行了初步的体内验证,但仍需要进一步研究以确保该技术的长期生物相容性和稳定性。
 相关新闻
相关新闻