热线:021-66110810,66110819
手机:13564362870


热线:021-66110810,66110819
手机:13564362870
2结果与分析
2.1冷冻对原生质体中Ca2+、Na+分布的影响
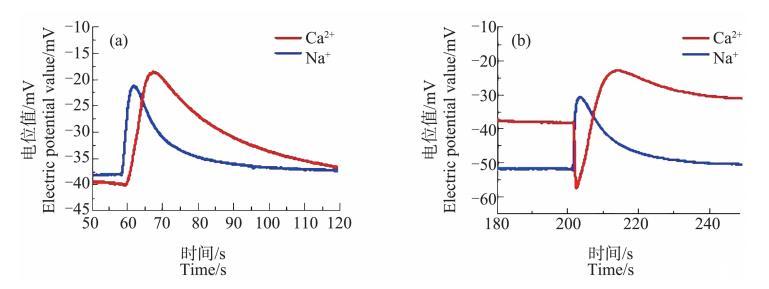
图 3 未经冷冻处理(a)与经冷冻处理(b)的芦荟原生质体破裂时形成的 Ca2+、Na+脉冲信号
未经冷冻和经冷冻处理的芦荟原生质体破裂时的Ca2+、Na+脉冲信号(以电极电位表示,下同)如图3所示。由图3(a)可知,未经冷冻处理的Ca2+、Na+信号在原生质体破裂前电位相对平稳,对应背景离子浓度。当原生质体开始破裂时,其周围的Ca2+浓度明显上升,直至离子浓度达到一个峰值,这段时间为T1,计算得到T1=(11.5±2.2)s。之后随着Ca2+慢慢向周围扩散,Ca2+浓度慢慢开始下降,直至趋于平稳,回复到背景浓度。整个过程结束后形成了一个向上的脉冲信号。这个脉冲信号为一个单一的脉冲,没有叠加其他细节,表明原生质体内Ca2+浓度分布比较均匀。Na+浓度脉冲信号与此类似,原生质体开始破裂到达到峰值所用时间为t1,计算得到t1=(4.0±0.98)s。图3(b)为经冷冻处理的原生质体破裂时产生的Ca2+、Na+浓度脉冲信号。与图3(a)对比发现,经冷冻处理后,Ca2+的脉冲信号发生了明显变化。虽然在破裂前Ca2+的浓度仍保持在背景浓度上,但当原生质体开始破裂时,经冷冻处理后的原生质体周围的Ca2+浓度并未像未经冷冻处理的原生质体那样快速上升,反而先显著地下降达到一个最低点,紧接着才迅速上升,在Ca2+浓度脉冲的前沿处形成一个明显的“凹陷”,从原生质体破裂到凹陷恢复所用时间为T2,经计算得到T2=(11.3±1.5)s,形成凹陷的深度为H,计算得H=(16.9±2.4)mV,从原生质体破裂到脉冲最高点所用时间T1’=(19.8±3.0)s。而经冷冻处理的原生质体的Na+的浓度脉冲信号则与未经处理的原生质体破裂时的离子信号情况基本相同,没有出现前沿凹陷的现象,t1’=(3.9±1.0)s。经对比发现,经冷冻处理后的Ca2+浓度脉冲从原生质体破裂开始至到达峰值所有的时间T1大于未经冷冻处理的Ca2+浓度脉冲的相应值,两者间存在显著差异(P<0.01),相差约8 s;而Na+浓度脉冲在冷冻前后t1几乎没有变化(二者无统计学差异,P>0.05)。
经冷冻处理后的芦荟原生质体,其破裂时形成Ca2+浓度脉冲信号前沿出现显著的凹陷现象,说明原生质体中的Ca2+分布不再均匀,靠近细胞中心浓度较高,而细胞膜附近浓度较低,产生了分层现象。
原生质体在低渗液吸水而膨胀破裂的。由于在这一过程中有水渗透进原生质体,如果原生质体内的Ca2+不能很快扩散进这些新渗入的水中,则在原生质体中靠近细胞膜处便会形成一个Ca2+的低浓度区,这自然会使脉冲信号的前沿处出现一个与低浓度区相对应的凹陷。
但从图3(a)中可知,未经冷冻处理芦荟原生质体在破裂时,其Ca2+浓度脉冲的前沿处并未出现这种凹陷。这说明,未经冷冻处理的芦荟原生质体内的Ca2+能够很快地扩散到渗入原生质体内的水中,维持了Ca2+浓度的均匀分布。这也表明,未经冷冻处理的原生质体对其内部的Ca2+浓度分布具有很好的调控能力。
经过冷冻后的芦荟原生质体在破裂时其Ca2+浓度脉冲信号前沿处出现了凹陷,表明其中的Ca2+流动性变差,或者说原生质体调控Ca2+浓度分布的能力遭到了破坏,使得Ca2+不能很快扩散到渗入的水中去,造成Ca2+浓度分布不均匀,出现了分层现象。
以往人们在研究低温胁迫或细胞的冷冻保存与复苏时,大多集中于研究胞外空间的离子流变化或水结冰时形成的冰晶对细胞的机械损伤,而没有注意到细胞调控Ca2+分布的能力的变化。赵明明等研究了低温处理后冬青叶片细胞内Ca2+水平变化,结果表明,细胞内Ca2+沉淀随温度的降低而有所增加。杨蕊等报道了在4℃下黄杨叶肉细胞中Ca2+和Ca2+-ATPase的变化,处理3~12 h后细胞间隙和液泡中的Ca2+沉淀颗粒较少,而细胞质和细胞核内的Ca2+增多,Ca2+-ATPase分布几乎未受影响,处理24 h后,细胞质和细胞核内Ca2+开始转移到细胞间隙和液泡中,Ca2+-ATPase的活性增强。在2018年,虽然Mori等在文章中提到低温会引起拟南芥细胞内Ca2+浓度的迅速升高。但这些研究均未提及Ca2+的浓度分布是否出现分层现象。因此,笔者的研究结果对于今后这方面的研究具有一定的借鉴意义。与Ca2+不同,Na+在冷冻处理后其浓度分布没有发生分层的现象,这可能与细胞对Ca2+和Na+分布的调控机制不同,及Ca2+和Na+在细胞抗冷冻反应中的作用有关,需要作进一步的深入研究。
2.2冷冻温度对芦荟原生质体中Ca2+、Na+分布的影响
为了进一步研究冷冻温度对芦荟原生质体中Ca2+、Na+浓度分布的影响,将芦荟原生质体冷冻至不同温度后,研究了其中的Ca2+、Na+浓度分布。
图4为冷冻至不同温度的芦荟原生质体,在低渗液中破裂时的产生的Ca2+、Na+浓度脉冲信号。(a)~(f)的温度分别为18℃、10℃、0℃、-5℃、-7℃和-10℃。从图中可以看出,当温度为18℃、10℃、0℃和-5℃时Ca2+、Na+的信号脉冲与未经冷冻处理的原生质体破裂时的离子信号基本相同,其信号前沿处均未出现凹陷。而当冷冻至-7℃时,Ca2+脉冲的前沿部分开始出现明显的“凹陷”,原生质体中Ca2+分布发生了改变。温度降低到-10℃时,凹陷依然存在。
使用焦锑酸钙沉淀的电镜细胞化学方法研究水稻幼苗细胞经1℃处理24、48 h后细胞中Ca2+定位分布的变化。研究发现,处理24 h胞质膜内侧形成了一圈Ca2+沉淀颗粒,当处理时间增加到48 h后,液泡中的Ca2+许多也分布在液泡膜的内侧,一部分颗粒趋向靠近液泡膜,而液泡中心部分的Ca2+分布似乎有减少的趋势。谢潮添等同样使用焦锑酸钙沉淀的电镜细胞化学方法,研究了2℃下的董棕幼苗叶肉细胞中Ca2+水平及其细胞超微结构的变化,研究表明,未经低温处理的董棕幼苗叶肉细胞,焦锑酸钙沉淀颗粒大量出现在液泡和细胞间隙中。48 h低温处理后,细胞基质和细胞膜上焦锑酸钙沉淀增加,叶绿体外膜受损。处理120 h后,焦锑酸钙沉淀大多分布在胞基质和细胞膜上,较少分布在液泡和核基质中。叶绿体、核膜和液泡膜严重破损,内部结构模糊。上述研究表明,低温处理有使Ca2+向细胞膜附近聚集的趋势,这与笔者的发现似乎刚好相反。不过,上述研究均使用了焦锑酸钙沉淀的电镜细胞化学方法,测量过程中细胞中的Ca2+以沉淀方式被析出,而且透射电镜观察需要对细胞进行固定,这些都影响了的Ca2+的流动性。而笔者所采用的方法则不需要对Ca2+进行沉淀析出,也不用对细胞进行固定处理,所得的结果应当更接近细胞内Ca2+的真实分布。

图4不同冷冻温度下原生质体破裂时的Ca2+、Na+浓度脉冲图注:(a)~(f)温度分别为18℃、10℃、0℃、-5℃、-7℃和-10℃。
有趣的是,在各种不同的温度下,Na+脉冲信号的前沿始终没有出现凹陷。这说明,冷冻胁迫会对芦荟原生质体中的Ca2+分布造成影响,但对Na+分布几乎没有影响。
2.3解冻时间对冷冻处理后Ca2+分布的影响
为了研究解冻时间对冷冻处理后Ca2+分布的影响,笔者选择冷冻至-7℃的芦荟原生质体为研究对象。将其解冻不同时间后,对其Ca2+浓度分布进行测量。图5为芦荟原生质体解冻后1、3和5 h后,其破裂时产生的Ca2+脉冲信号的情况。可以观察到经冷冻处理后的原生质体的Ca2+浓度脉冲前沿处的“凹陷”现象在解冻5 h后依然没有消失,原生质体中的Ca2+浓度分层的现象依然存在。这说明,冷冻造成的原生质体内Ca2+流动的降低,或者说原生质体对Ca2+浓度的调控能力的下降,并不会在原生质体解冻后马上恢复,而是会持续相当长的时间。
2.4 ZnO NPs预处理对冷冻原生质体中Ca2+、Na+分布的影响
图6为经不同浓度ZnO NPs预处理后再进行冷冻(温度降至-7℃)的芦荟原生质体,在低渗液中破裂时产生的Ca2+、Na+浓度脉冲信号。图中(a)~(d)的ZnO NPs浓度分别为30、50、70和90 mg·L-1。
由图6可知,不同浓度ZnO NPs预处理后原生质体破裂时的Ca2+浓度脉冲曲线在前沿处也都出现了“凹陷”现象。但与未经ZnO NPs预处理的情况相比,经处ZnO NPs理后Ca2+浓度脉冲前沿处的凹陷程度都明显减小,凹陷深度H为(1.5±0.78)mV。明显小于冷冻胁迫下未加ZnO NPs的凹陷深度(16.9±2.4)mV,相差约为15.4 mV,统计分析表明二者存在显著差异(P<0.01)。这说明,二者中的Ca2+浓度分布情况有明显差异,Ca2+浓度分布发生变化。虽然大量研究都已表明,ZnO NPs对植物细胞具毒性,如破坏膜的完整性,DNA链断裂,抑制叶绿素的形成等。但至少从笔者的研究结果来看,ZnO NPs预处理对抵抗冷冻所造成的Ca2+流动性下降,维持细胞对Ca2+浓度分布的调控能力方面具有一定的积极作用。与前面的情形一样,Na+浓度脉冲的形状仍没有明显的变化,没有出现前沿凹陷在现象。
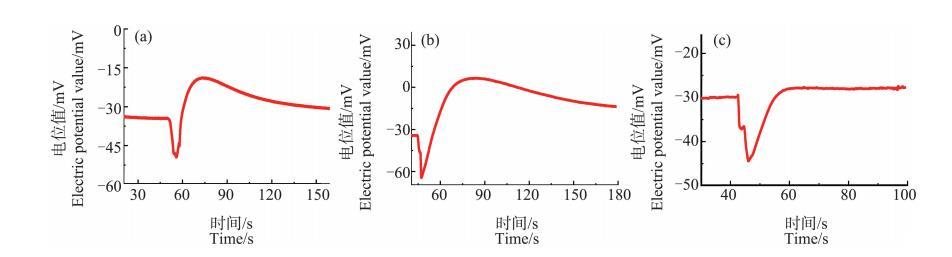
图5解冻后1 h(a)、3 h(b)和5 h(c)后芦荟原生质体破裂时产生的Ca2+脉冲信号
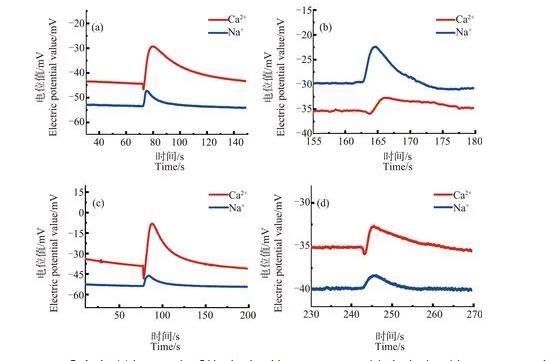
图6不同浓度ZnO NPs预处理后冷冻胁迫下原生质体破裂时的Ca2+、Na+浓度脉冲图注:(a)~(d)中ZnO NPs浓度分别为30、50、70和90 mg·L-1。
2.5 ZnO NPs对冷冻后原生质体中Ca2+、Na+分布的影响
图7为芦荟原生质体先经冷冻处理(温度降至-7℃)后,再用不同浓度的ZnO NPs进行后处理,最后将其放入低渗液中所测得的Ca2+、Na+浓度脉冲信号。
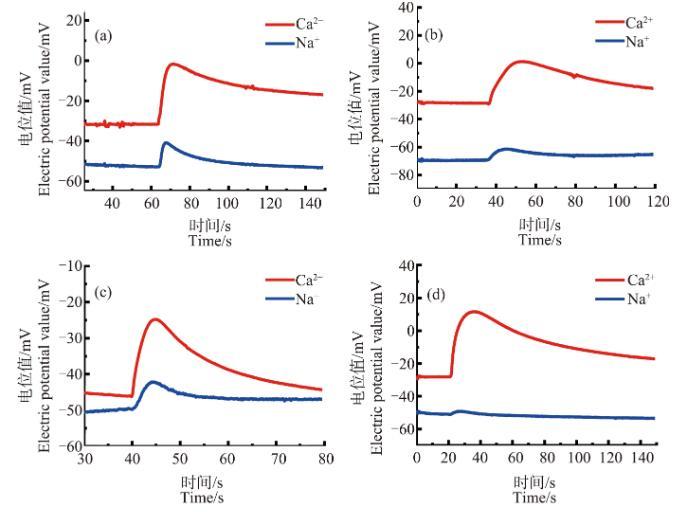
图7 ZnO NPs处理解冻后原生质体破裂后Ca2+、Na+信号脉冲图注:(a)~(d)中ZnO NPs浓度分别为30、50、70和90 mg·L-1。
由图中可以看出一个十分有趣的现象。解冻后再经不同浓度ZnO NPs处理的原生质体在低渗液中破裂时,不但Na+浓度脉冲的前沿处没有出现凹陷,Ca2+浓度脉冲前沿处的“凹陷”也消失了。这说明,ZnO NPs处理使得芦荟原生质体中由于冷冻造成的Ca2+浓度分层消失了,ZnO NPs的加入使得Ca2+浓度分布又发生了新的变化,造成这一现象的具体原因目前还不是十分清楚。
2.6 ZnO NPs对未经冷冻的芦荟原生质体中Ca2+、Na+分布的影响
为了进一步探究冷冻前后ZnO NPs处理可使浓度脉冲前沿凹陷深度减小甚至消失这一问题,了解原生质体内部Ca2+、Na+浓度分布的变化情况。笔者检测了不同浓度ZnO NPs处理3和18 h的未经冷冻的芦荟原生质体破裂过程中产生的Ca2+、Na+浓度脉冲情况,检测结果如图8和图9所示。
由图8可知,当ZnO NPs浓度为30、50和70 mg·L-1时,经3 h处理后,芦荟原生质体破裂时产生的Ca2+、Na+信号中均未出现前沿凹陷的现象。而当ZnO NPs浓度为90 mg·L-1时,发现Ca2+浓度脉冲的前沿有轻微的凹陷。另一个值得注意的现象是,图8(b)~(d)中,在脉冲上升段的开始处,其上升趋势更加陡峭。而且,随着处理时间的增加,这种趋势更加明显,如图9所示。
从图9中可以明显看出,(a)~(d)中4组脉冲信号的上升段的开始处,脉冲上升速度极快,与其后部分的上升速度有明显区别。笔者统计了未经ZnO NPs处理、经ZnO NPs分别处理3和18 h的Ca2+浓度脉冲上升部分时间T1和该部分前1/3处时间T1/3,如图10所示。
经过比较发现,未经ZnO NPs处理与ZnO NPs处理的Ca2+浓度脉冲其从原生质体破裂到达到最大值所用的时间T1基本一致,而在上升的前1/3处所用的时间T1/3相差明显。
这一明显区别表明,与冷冻造成的原生质体内靠近细胞膜处Ca2+浓度下降不同。经ZnO NPs处理后的芦荟原生质体中,靠近细胞膜处的很小范围内,Ca2+浓度有较为明显的上升趋势。这说明,Ca2+浓度分布与未经ZnO NPs处理时相比发生了变化,猜想可能是ZnO NPs使得芦荟原生质体中Ca2+在细胞膜附近分布较集中,从而导致细胞膜破裂后,在脉冲前沿形成较明显的浓度变化。可能正是这一现象,使得经ZnO NPs预处理的芦荟原生质体,在冷冻后其Ca2+浓度脉冲前沿处的凹陷变浅;也会使先冷冻再用ZnO NPs进行后处理的芦荟原生质体的Ca2+浓度脉冲前沿凹陷消失。这当中的具体机制值得深入研究。经过不同时间的ZnO NPs处理,Na+浓度脉冲的形状依然没有明显变化,没有出现前沿凹陷在现象。
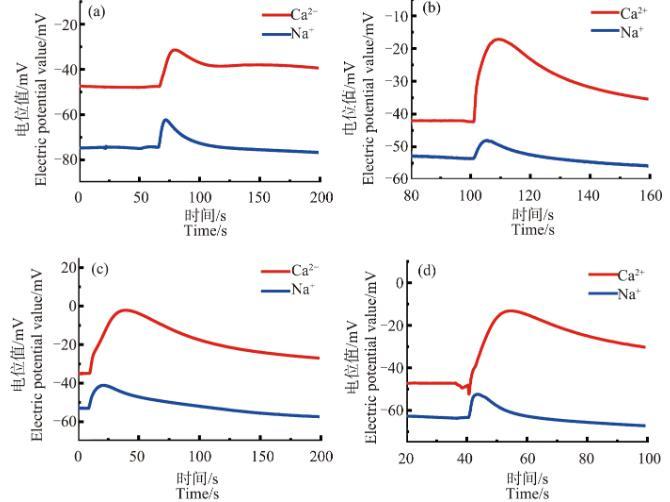
图8不同浓度的ZnO NPs处理3 h后的芦荟原生质体破裂时的Ca2+、Na+浓度脉冲注:(a)~(d)中ZnO NPs浓度分别为30、50、70和90 mg·L-1。
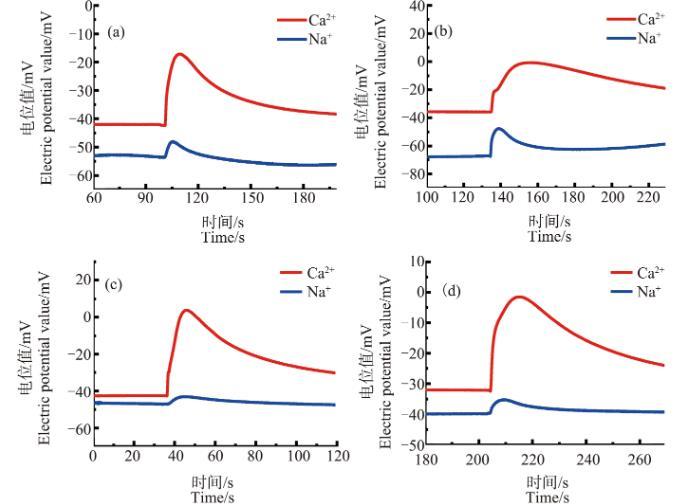
图9不同浓度ZnO NPs处理18 h后的原生质体破裂时的Ca2+、Na+浓度脉冲图注:(a)~(d)中ZnO NPs浓度分别为30、50、70和90 mg·L-1。
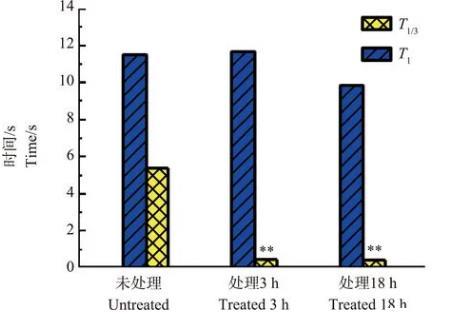
图10未处理、ZnO NPs处理3和18 h的Ca2+浓度脉冲上升部分时间T1和T1/3
综上,使用Ca2+离子选择性微电极检测了经冷冻处理后的芦荟原生质体在低渗液中破裂时产生的Ca2+浓度脉冲信号。研究了冷冻温度、解冻时间和ZnO NPs处理等因素对芦荟原生质体中Ca2+分布的影响。发现芦荟原生质体被冷冻至-7℃以下时,其Ca2+脉冲信号前沿处发生明显的“凹陷”,Ca2+分布出现分层现象。靠近细胞中心浓度较高而细胞膜附近浓度较低。这说明,冷冻造成芦荟原生质体中Ca2+的流动性下降,原生质体对Ca2+浓度分布的调控能力降低。这一现象在原生质体解冻5 h后仍未消失。
经过ZnO NPs预处理后再进行冷冻的原生质体,其脉冲凹陷深度明显减小;而当用ZnO NPs对解冻后的原生质体进行后处理时,Ca2+分层现象消失。这可能是由于ZnO NPs处理使得芦荟原生质体中Ca2+分布趋近于细胞膜附近导致的。这表明,尽管ZnO NPs对植物细胞具有一定的毒性,但其在防止冷冻造成的Ca2+流动性下降,维持细胞Ca2+分布的调控能力方面,仍然具有一定的积极作用。
 相关新闻
相关新闻