热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
作者
刘秋杏,邓洁,崔升淼
广东药科大学中药学院
摘要
皮肤角质层是经皮给药的主要屏障,微针可穿刺皮肤角质层,在表皮层和真皮层之间形成微米级的孔道,促进生物大分子类药物和难溶性药物分子的渗透,进而克服了传统药物经皮渗透率低的问题。水凝胶微针具有一定的机械强度,可穿刺皮肤角质层,吸收皮肤间组织液,在皮肤生物标志物的识别方面发挥重要作用,是近年来的研究热点之一。笔者从水凝胶微针的形成机制、透皮给药应用方面以及存在的一些问题总结了近年国内外的相关代表文献,并展望了这一领域的未来发展。
正文
皮肤作为人体最大的器官,约占人体体重的10%以上,为经皮给药提供一定的空间。它主要由表皮和真皮两大层组成,角质层位于表皮最外层,厚约15~20μm[1],具有特殊的组分和致密的结构,是药物分子扩散和渗透的主要障碍。表皮下为真皮,约300~5 000μm厚,包括汗腺、神经末梢和毛细血管等。药物主要通过细胞内、细胞间和跨膜运输3种途径在皮肤中扩散[2]。皮肤附属物仅占体表总面积的0.1%,对离子和不能自由穿透角质层的强极性分子的运输起着至关重要的作用。此外,角质层的结构和厚度会随着年龄、环境及病理条件等方面而发生改变,影响药物分子的渗透。然而,由于角质层要保护皮肤免受病原体和身体的攻击,皮肤会变得坚韧且使药物分子难以渗透,从而限制了透皮给药制剂的应用[3]。
与传统的递药途径(如口服,注射)相比,透皮给药主要在皮肤上放置微针贴片,穿刺皮肤角质层,通过皮肤组织将药物输送到血液中,因具有自我给药、按需给药、患者顺应性好、避免肝脏的首过效应和胃肠道的药物降解等优点而备受关注[4]。渗透增强技术的迅速发展克服了角质层的屏障障碍,拓宽了透皮给药在药物化疗、基因治疗、疫苗传递等领域的应用[5]。微针(microneedles)由单个或多个微米级别的针头组成,直径一般为几百微米,高度可达毫米级别,可分为固体微针(solid microneedles)、中空微针(hollow microneedles)、涂层微针(coated microneedles)、溶解微针(dissolvable microneedles)和水凝胶微针(hydrogel microneedles),在美容、治疗及诊断等领域有着广阔的应用前景。水凝胶微针分为天然水凝胶微针与合成水凝胶微针,分别由天然高分子(如透明质酸、明胶、琼脂等)和合成高分子(如聚乙烯醇、聚丙烯酸钠、甲基丙烯酸类聚合物等)所制备[6],其中一些聚合物由于具有良好的生物相容性、可降解性和无毒性而受到越来越多的关注[7],使得水凝胶微针成为了微针领域的研究热点之一。笔者从水凝胶微针的形成机制、应用研究以及存在的一些问题总结了近年国内外的相关代表文献,并对这一领域的未来发展进行展望。在Web of Science以“hydrogel microneedle”为关键词检索近10年水凝胶微针发表的文献情况,见图1。
1、水凝胶微针的形成机制及制备
水凝胶微针具有足够的机械强度穿透皮肤,植入皮肤后吸收组织液,造成聚合物的膨胀,继而形成连续的、不可堵塞的水凝胶管道,打开了药物释放的扩散通道,使药物释放并在体内发挥治疗效果。水凝胶的凝胶化可通过多种机制实现,包括聚合物链的物理交联、静电相互作用和共价化学交联,最后形成吸水膨胀的亲水性聚合物网络,聚合物网络具有多孔结构,可将药物包裹其中,减少药物在运输过程的损失,增强药物的疗效。这一类聚合物还具有广泛可调的物理和化学性质[8],能协助治疗过程中药物的可控释放。水凝胶微针是将聚合物形成水凝胶后再通过一定的方法注入微针模具,静置干燥一定时间后脱模,并需干燥保存。水凝胶的凝胶化机制和水凝胶微针的透皮机制见图2。
1.1物理交联
许多天然聚合物,如海藻来源的多糖和动物来源的蛋白质,包括琼脂糖,透明质酸,胶原蛋白等,可形成热驱动水凝胶。在凝胶化过程中,由于温度的变化,聚合物链会发生物理缠结,这种变化主要由聚合物溶解度的改变和主链的形成所引起,见图2A。温度升高或降低,可能导致热凝胶化,其中转变温度分别为较低的临界温度(LCST)和较高的临界溶液温度(UCST)[9]。UCST的大分子包括天然聚合物,如明胶及合成聚合物,如聚丙烯酸,当温度降低到UCST以下时,其他一些大分子就会表现出LCST行为,如合成聚合物(N-异丙基丙烯酰胺)。

采用双物理交联方法可制备具有超高韧性的可模塑水凝胶。丙烯酸单体先在壳聚糖(Ch)浓溶液中进行了原位聚合,得聚电解质络合物水凝胶,随后将Ag+离子引入其中,在氨基和羧基之间形成配位键,高密度静电相互作用和配位键赋予水凝胶超高韧性[10]。天然高分子水凝胶的力学性能较差,溶胀是导致水凝胶弱化的关键因素之一。以明胶的自组装三螺旋结构、明胶接枝和自由疏水基序的疏水聚集为基础,赋予超分子明胶水凝胶不膨胀、热塑性和韧性强的特性,加热时显示很高的延展性,但冷却到室温后转变为极强的韧性[11]。物理交联无需使用化学交联剂,具有良好的生物相容性与安全性,能实现循环利用,但这一类水凝胶韧性较强,易受温度影响,不耐用,且难以控制交联条件。
1.2静电相互作用
自发的物理凝胶作用取决于螯合或静电相互作用。天然大分子结构复杂,根据主链的长短会产生不同程度的静电作用,见图2B。尽管许多天然聚合物(如海藻酸钠)在中性条件下由于羧基的存在而带负电,但当氨基占主导地位时(如明胶和壳聚糖)也可能带正电。相比之下,有些合成电解质能更好地控制静电性能,比如聚赖氨酸(PLL)/丙烯酸树脂(PAA)对。海藻酸盐由甘露糖醛酸盐和葡萄糖醛酸单体组成,带负电,可与其他分子的阳离子基团发生静电结合,形成水凝胶。大多海藻酸钠凝胶优势在于纳米多孔性和天然的亲水性,使得装载的小分子药物快速扩散。若改变交联和凝胶药物键的形成,则可延长药物释放时间。
分子间电荷的相互作用大小会直接影响药物的释放速度。Yu等[12]以乙二醇二甲基丙烯酸酯(EGDMA)、3-(丙烯酰胺基)苯硼酸(3APBA)、(二甲氨基)丙烯酸乙酯(DMAEA)为单体,通过原位光聚合方法与胰岛素混合制备得葡萄糖响应性微针(GR-MN),当GR-MN暴露于高血糖条件下时,PBA与葡萄糖发生可逆反应,生成环硼酸酯,增加聚合物基质中的负电荷,增强微针的膨胀,引发微针装载的胰岛素快速扩散到皮肤组织中。同时,负电荷密度的增加也减弱了带正电荷DMAEA分子与带负电荷胰岛素分子之间的静电相互作用,进一步促进了胰岛素的释放。同一课题组的Wang等[13]也充分利用了聚合物与胰岛素分子之间的静电相互作用调整正电荷组与PBA的比值,使复合物在正常血糖条件下抑制胰岛素释放,在高血糖条件下促进胰岛素释放。静电交联方式制备的水凝胶最大优势在于达到对药物的可控释放,但载药量较少,需要持续释药方可达到可观的治疗效果,还有可能给患者带来疼痛感。
1.3化学交联
与物理交联相比,化学交联在稳定水凝胶基质方面效果更好,在凝胶化过程中大大提高了灵活度和时空精度,见图2C。传统化学交联机制包括缩合反应、自由基聚合和醛互补等[14]。在细胞中可直接发生生物合成和水凝胶的形成,如叠氮化合物炔和叠氮二烷基环加成反应以及硫烯光电耦合反应[15]。
Snchez-Tllez等[16]展示了一种新的无机交联方法,把透明质酸钠(HA)与氨基硅烷进行化学修饰,后与有机-无机硅氧烷结构交联合成3D杂化水凝胶,新型无机交联网络为HA提供了强化学键,限制了其天然亲水性和改善了流变性能。交联机制的转变赋予水凝胶新的特性,有利于两种或两种以上交联方式的合并,开发出应用更加广泛的水凝胶。Wang等[17]选择弹性蛋白样蛋白(ELP)氨基酸序列来实现位点特异性的化学交联和热响应性的物理自组装,同时控制化学交联程度,在不改变ELP氨基酸序列的情况下调节材料的微观结构,制备了三维微结构水凝胶。相对于物理交联和静电交联,化学交联的生物相容性和安全性低,无法实现循环利用。
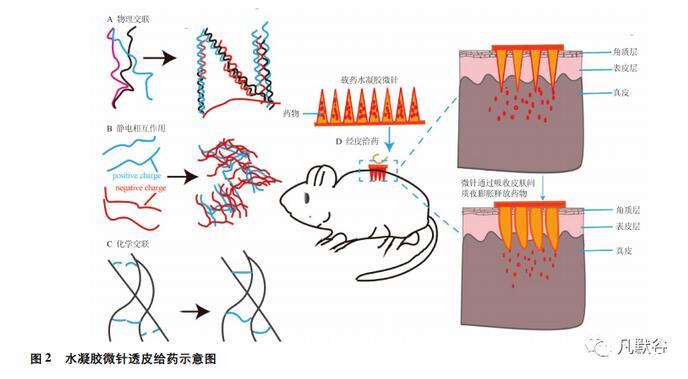
尽管每种凝胶化方法都有其优点和局限性,但该领域一直向结合多种组分和/或机制以实现改进水凝胶配方的方向发展,使得水凝胶微针具有多种释药方式,通过水凝胶纤维交联密度调节药物递送速率,实现更好的经皮给药效果。
1.4水凝胶微针的制备
水凝胶微针具有多种制备方法,随着水凝胶材料及交联机制的不同而发生变化。其制备材料包括天然高分子(如透明质酸、明胶、琼脂等)与合成高分子(如聚乙烯醇、聚丙烯酸钠、甲基丙烯酸类聚合物等),分子间可通过物理交联、静电相互作用或者化学交联形成水凝胶,最后通过模板法制备得水凝胶微针。天然高分子可经过化学活性部分改性,在其主链上提供交联位点。Luo等[18]利用甲基丙烯酸基团对透明质酸和明胶的改性,在紫外光条件下自发形成水凝胶微针。合成高分子却是经过相变交联形成水凝胶微针。Yang等[19]制备一种胰岛素和聚乙烯醇混合溶液,随后将其注入微针模具上,通过真空干燥、冷冻及解冻,最后脱模并干燥,得到相变水凝胶微针。这些制备方法赋予水凝胶微针一定的机械强度,可穿透皮肤的角质层,直达病变部位进行药物的可控定位释放。
2、水凝胶微针的国外应用研究
水凝胶微针在疾病的诊断和治疗方面研究广泛:①诊断方面:提取皮肤间质液,检测人体重要的生物标志物,如葡萄糖[21]、核酸[20,22]、蛋白质等;②治疗方面:用于肿瘤、糖尿病[23]、青光眼等。
2.1诊断方面
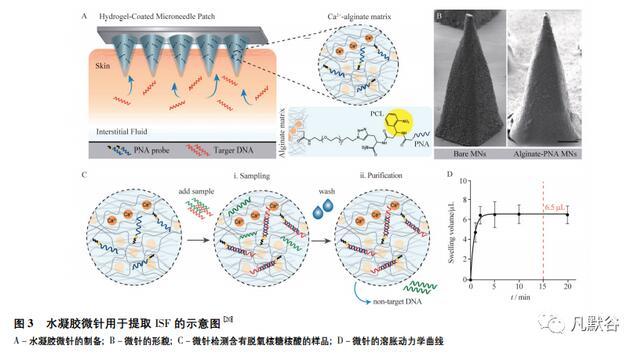
皮肤间质液(interstitial fluid,ISF)存在皮肤层,属于人体的一种体液,含有与临床分析有关的一系列生物标志物。近年来,微针从皮肤中提取ISF在微创诊断和生物传感器方面受到越来越多的关注。微创技术是早期诊断癌症、糖尿病、皮肤病等多种疾病的有效方法,主要通过从液体活检中取样,减少血液污染的风险,检测无细胞核酸生物标记物。水凝胶微针要求材料具有优异的溶胀能力,以一种无痛和微创方式提取皮肤间质液,检测特定的生物标志物。现有的水凝胶微针以微创方式提取ISF需要十多分钟才能收集足够的体积进行临床分析。为缩减取样时间,很多学者致力于研究新型水凝胶微针。Dana Al Sulaiman等[20]设计了一种海藻酸钠-肽核酸杂交材料的微针,见图3,在2 min内取样6.50μL液体,分离和检测皮肤间质液中核酸生物标记物的特异性序列,同时使捕获的miRNA能够被原位检测。克服了以往微针低采样容量(小于2μL)和长采样时间(大于1 h)的缺点。Zheng等[24]介绍了一种渗透压驱动的水凝胶微针,由渗透质(麦芽糖)和水凝胶(甲基丙烯酸)组成。在提取过程中,渗透压细胞溶解在基质中,并提供渗透压,增加ISF从皮肤到水凝胶基质的扩散。结果显示,3 min内从离体猪皮中提取7.90μL ISF,从活体小鼠皮中提取3.82μLISF,而对照组(即不含渗透压细胞的水凝胶微针头)需要10min以上才能达到类似的效果。提取出的ISF可以定量生物标记物,如葡萄糖和万古霉素[25],同时释放一定量的治疗药物,如胰岛素。通过与电子葡萄糖传感器的集成,整个系统可以直接、快速地分析提取葡萄糖。这种检测方式便于检测患者体内的靶分子,为糖尿病患者的治疗提供理论依据。Chen等[23]制备了一种无电子、无酶、无纳米颗粒的智能人造皮肤胰腺———微针贴片,由葡萄糖敏感的硼酸盐水凝胶和生物相容性丝素半穿透网络构成,模拟胰腺功能,在水环境下至少稳定2个月,以一种安全、经济有效、便利的方式实现了按需胰岛素给药,给予患者急性和持续的血糖控制。不同于Chen的设计,He等[21]研制了一种聚乙烯醇(PVA)和壳聚糖(CS)水凝胶微针,用于护理点测试(POCT)。PVA/CS水凝胶微针干燥后机械强度增强,有利于穿刺皮肤,并且水凝胶具有多孔微观结构,为提取ISF提供了良好的溶解度,PVA的热降解性能有助于提高取样速率,最后在1 d内检测兔皮肤中葡萄糖水平,为基于皮肤的POCT提供了一个更大的发展平台。
循环细胞外囊泡的生物分子,例如蛋白质和核酸,能直接反映与疾病有关的更深层信息[26]。Yang等[22]介绍了一种水凝胶微针贴片,可在15 min左右从ISF中快速、简便地捕获EB病毒无细胞DNA(EBV-Cf-DNA)。体内实验结果表明,EBV-DNA是从鼻咽癌细胞瘤中释放出来,最大捕获效率为93.6%。根据捕获效率,可以判断Cf-DNA相关疾病和对癌症转移患者具有广泛的微创意义,有助于未来制定后续的癌症治疗方案。
2.2治疗方面
以水凝胶为基础的药物递送系统治疗范围已扩展至多个医药领域,例如治疗心血管疾病、癌症和慢性疼痛等。水凝胶微针一般由疏水性聚合物经过物理或化学交联形成网络结构,大多具有生物相容性和可生物降解性,作为难溶性药物传递的多功能平台。聚合物网络内的交联度可以调节网孔大小和孔隙率,从而进一步改变水凝胶的机械和药物释放性能,可实现快速高剂量释放或缓慢受控剂量释放。
2.2.1肿瘤的治疗
肿瘤的治疗方法包括手术切除、药物化疗和放射治疗等,手术切除对患者的伤害极大,且存在容易复发的风险。药物化疗会给患者带来巨大的疼痛感和精神压力,且易产生严重的副作用和癌细胞的耐药性。给药方式有注射、口服给药等多种全身给药方式,导致药物生物利用度低,也带来很多不良反应。与全身给药相比,局部给药在浅表肿瘤中显示出明显的优势,可以提高生物利用度,避免与全身暴露相关的非靶向效应。水凝胶微针作为新一代透皮给药方式,能克服皮肤角质层的障碍,为药物的有效渗透创造一系列微通道。
甲基丙烯酸酯基团与天然聚合物明胶可自发交联形成水凝胶(GelMA)。Luo等[18]已经证明明胶-甲基丙烯酰(GelMA)可用于制备具有理想释放曲线的微针阵列和水溶性药物的递送。同一课题组的Zhou等[27]将两亲性环糊精(βCD)修饰凝胶侧链,得到的肽-糖杂化材料作为水不溶性药物的载体,同时捕获小分子并形成包合物,作者首次设计了一个三维皮肤癌筛查模型,将黑色素瘤细胞B16F10球状体嵌入水凝胶微针中,微针能够穿透细胞外基质并有效地将治疗药物输送到靶点。通过比较球体对GelMA-β-CD/CUR(姜黄素)非透皮贴片的反应来评估微针的疗效,结果显示,Gel-βCD/CUR-MN贴片治疗能更有效地抑制黑色素瘤球体生长。GelMA和β-CD这2种材料在改善亲油性化合物的递送和开发亲水性和疏水性药物的组合疗法方面具有巨大潜力,可用于以微创方式治疗各种疾病。
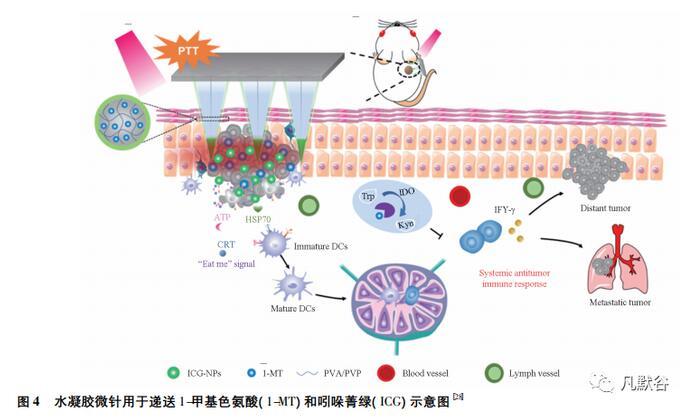
表皮和真皮中富含抗原呈递细胞(APCs)和朗格汉斯细胞,皮肤组织中的天然免疫微环境能与运送的药物协同发挥治疗效果。水凝胶微针作为抗程序性死亡受体(PD1)抗体与其他检查点抑制剂的载体,可用于黑色素瘤免疫治疗。Chen等[28]构建一种核-壳结构微针(CS-MNs)阵列,见图4,以可降解的聚乙烯吡咯烷酮(PVP)和聚乙烯醇(PVA)交联形成的凝胶为核心,负载1-甲基色氨酸(1-MT)采用吲哚菁绿(ICG)纳米颗粒沉积在微针壳上的方法制备了CS-MNs。微针插入肿瘤部位后,吸收组织液溶解,随后释放ICG-NPs和1-MT,经近红外照射后,ICG-NPs有效地将近红外光能转化为热消融原发肿瘤,生成肿瘤相关抗原和损伤相关分子模式(DAMPs),促进了树突状细胞的成熟和免疫刺激性细胞因子的分泌。释放出的1-MT逆转了吲哚胺2,3-双加氧酶介导的免疫抑制,最终引起有效的系统免疫应答。体内结果显示,80%的黑色素瘤被根除,最后在超过120 d内无复发存活。微针作为免疫原性细胞死亡(ICD)诱导剂和免疫治疗剂的载体具有独特的优势:①通过将载药针尖嵌入浅表肿瘤大大提高了ICD诱导剂在损伤部位的积累;②通过设计良好的阵列结构,提供空间可控的药物分布和渗透;③丰富的免疫增强剂有助于提呈抗原,增强了免疫应答。
水凝胶微针可用于小分子经皮给药,提高药物的生物利用度。Huang等[29]合成了光交联的甲基丙烯酸右旋糖酐(DexMA),以此为原材料,构建一种针尖负载阿霉素(DOX)和曲马替尼(Tra)的新型微针,能成功穿透表皮层,实现药物的缓释。Tra还可以逆转P-糖蛋白介导的多药耐药,有效阻断P-糖蛋白对DOX的外排。结果显示了同时释放Tra和DOX,在B16细胞异种移植裸鼠模型中达到协同作用。这种新型微针的优势在于药物的可控释放,进而避免药物带来的不良反应。
2.2.2糖尿病的治疗
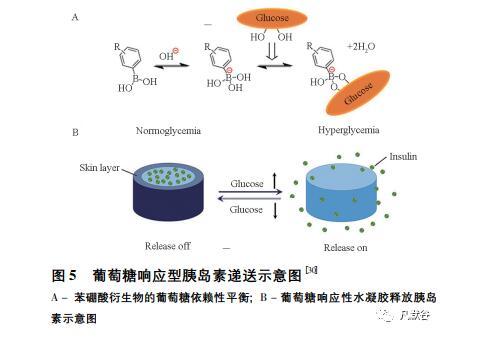
糖尿病是最常见的慢性病之一,其血糖水平难以控制。患者需要每天检测血糖水平,并定期注射胰岛素或服药以持续控制血糖水平。然而,反复采血和注射胰岛素会给患者带来巨大的疼痛和压力。胰岛素过量会导致癫痫发作、意识丧失、甚至死亡。水凝胶微针的检测能达到无痛取样的效果,控制胰岛素的释放。Chen等[30]利用生物相容性丝素蛋白(SF)和苯基硼酸/丙烯酰胺制备得智能水凝胶微针,见图5,SF作为微针基底层,葡萄糖响应性水凝胶形成针尖层,微针穿透皮肤后,遇到葡萄糖浓度升高时,自主释放胰岛素,控制血糖浓度。这种水凝胶微针在水体系中放置一周后仍保持原来的针型,解决了微针溶解在皮肤内的安全性问题,为持续释药提供了机会。
Wang等[31]采用另一种方式调节血糖水平,他们设计了一种核-壳结构的聚乙烯醇(PVA)凝胶微针,以葡萄糖氧化酶(GOx)为核心,外壳嵌入过氧化氢酶(CAT),对升高的血糖浓度具有响应性。为实现对H2 O2敏感的胰岛素释放,以4-硝基苯基4-(4,4,5,5-四甲基-1,3,2-二氧杂醇-2yl)碳酸苄酯(胰岛素NBC)对胰岛素进行化学修饰,然后装载到水溶性PVA基质上。当微针暴露于高糖浓度下,能产生局部高水平H2O2,胰岛素NBC被氧化和水解,导致游离胰岛素的快速释放,控制血糖浓度。该核-壳结构微针主要以生理因子控制的方式为经皮给药提供了一种无痛新技术,提高了生物相容性。
2.2.3其他疾病的治疗
类风湿性关节炎是一种涉及多个关节的系统性疾病,病因和发病机制极为复杂,发病部位涉及多个关节,早期的药物治疗方式多为口服,但长期服用抗风湿病药物会出现明显的毒副作用,最后导致临床疗效逐渐下降,使患者的病情无法得到有效的控制。在临床环境中通过局部注射一定剂量的药物不仅需要专业的操作,还可能带来关节损伤和感染的风险。水凝胶微针可作为药物、蛋白抑制剂的载体,穿透皮肤的角质层,递送靶向治疗药物或蛋白抑制剂,减轻药物对胃肠道的不良反应。
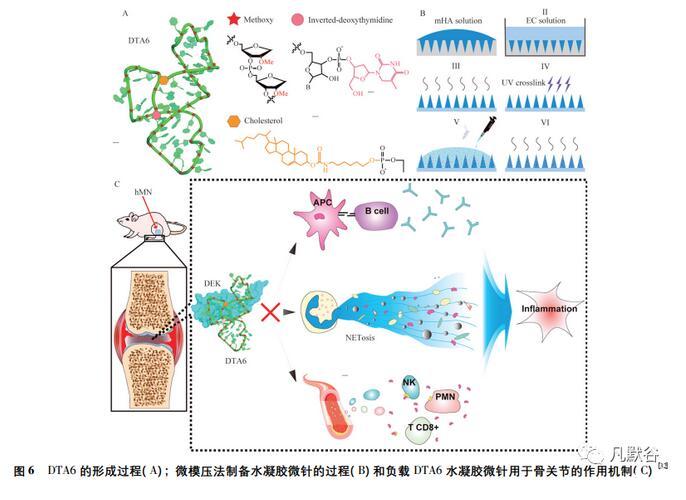
Cao等[32]研究了一种透明质酸水凝胶微针递送化学修饰的适体用于类风湿性关节炎的治疗。作者首先利用核糖糖单元上的甲氧基和反向脱氧胸苷DTA4修饰DTA(一种阻断DEK蛋白的核酸适体),后用胆固醇在其5'端修饰DTA4,形成DTA6,装载于甲基丙烯酸酯改性的透明质酸水凝胶微针,通过穿刺皮肤,快速释放DTA6进入真皮。结果显示,DTA6显著降低炎症RAW264.7细胞的DEK表达,保护小鼠关节免受软骨/骨侵蚀。相对于可溶性微针的给药方式,水凝胶微针不仅可增加核酸适体填充到微针模具空腔的装载量,还可以通过调节适体溶液的浓度来控制水凝胶微针的负载量,避免了制备过程适体的浪费和损失,见图6。
也有研究表明水凝胶微针可用于青光眼的治疗。青光眼目前的治疗方法主要通过药物或手术来降低眼压,因此难以避免药物及术后带来的副作用。CHAE等[33]利用微针注射原位形成的水凝胶来扩大眼睛的脉络膜上腔,增加眼房水排出,从而降低眼压达到治疗青光眼的目的。这种新型治疗方式有可能成为一种新的、非手术的、无药物的治疗方法,为青光眼的治疗开辟了新途径。
3、水凝胶微针的国内应用研究
目前国内针对水凝胶微针的研究较少,主要集中于促进疏水性药物的经皮吸收。董晓陶等[34]以聚乙烯醇为原材料,制备一种相转化水凝胶微针,采用浸泡吸附法装载蛋白药物。体外释放结果验证了水凝胶微针可促进蛋白药物的快速释放。此方法用于生物类大分子的载药研究,适合快速释药的情况。也有一些研究者验证了水凝胶微针可促进中药某些难溶性成分的透皮吸收,比如熊果苷[35]、青藤水碱[36]等,但验证方法只是采用了Franz扩散池和动物皮肤释放实验,缺少进行动物体内的药效研究,若后期加大水凝胶微针关于中药难溶性药物的体内药效验证,相信水凝胶微针在中-西药联用治疗肿瘤、糖尿病、骨关节炎等疾病具有一定的潜力。
4、水凝胶微针存在的问题分析
水凝胶微针分为溶解微针和可降解微针,具有一定的机械强度穿透皮肤,起到诊断或治疗的目的。与非水凝胶技术相比,水凝胶微针技术具有更大的应用前景,但也存在一些待解决的问题。
4.1生物安全性的问题
溶解或可降解微针采取经皮给药的方法,其针头很大一部分基质在皮肤中溶解,很多研究者[18,27-29]往往会忽略基质溶解在皮肤后的去向或缺乏进行相关的实验验证基质对皮肤的安全性。这一类微针不适用于每日给药,若每天或短时间内通过微针给药,基质在皮肤中的停滞时间会增加患者的依从性或者其他潜在的副作用。
水凝胶微针的制备条件也存在一定的安全性问题:①溶胀性凝胶材料普遍需要紫外光照射[29]或者高温加热等条件引发交联,这些剧烈的制备条件阻碍了蛋白质、核酸等易发生变性的生物大分子类药物递送。②在制备过程中常用的有机溶剂如四氢呋喃、氯仿、二甲基亚砜等可能在微针中存在溶剂残留,在使用后可能对患者的皮肤产生刺激性,带来一定的安全隐患。
因此,为了加快微针的临床应用,应该要从制备材料、物理治疗及药物治疗对健康组织毒性等方面的安全性问题进行系统评估。另外,探究微针在皮肤内溶解释放后药物释放分布动力学以及针体材料与药物相互作用后的释放性能和体内分布也具有一定的重要意义。
4.2微针自身存在的问题
水凝胶微针植入皮肤的深度、表面均匀性、稳定性等因素与患者的年龄、体重、微针穿刺皮肤的力度大小有关。老年人患者与儿童患者所能承受的力度较小,对微针制备材料的敏感性、针体高度、针尖直径、载药量等具有较高的要求。微针穿刺皮肤后在皮肤中的停留时间对药物释放量、药物种类也缺乏一个具体有效的评判标准。微针的载药量小,需连续给药,才有可能达到药物的有效浓度,如何制定微针的载药量标准,后期还需加大研究力度。现在大部分种类微针的制备都无法满足上述因素,因此难以进入临床研究阶段。
5、结论与展望
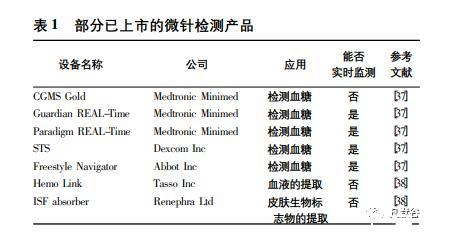
目前,水凝胶微针材料层出不穷,微针性能日渐完善,并在临床上取得了一定的成功,比如用于监测ISF葡萄糖微针传感器已经上市销售,见表1。
水凝胶微针作为一种新型的透皮给药方式,在透皮药物递送和生物诊断方面的研究日益增加,主要集中在生物诊断、肿瘤及糖尿病的治疗方面,其最大优势在于对药物的可控释放及原病变部位的定点释放,可通过调节递送药物的浓度来控制安全范围内的用药分量。此外,通过对水凝胶微针的制备材料进行一定的功能修饰,比如一些光热材料(金纳米棒、普鲁士蓝、吲哚菁绿等),光敏剂(原卟啉、钛菁锌、二氧化钛等),赋予水凝胶微针产生对外源刺激(温度、磁场、光等变化)或内源性刺激(pH、酶、氧化还原梯度等变化)的功能,同时结合递送的药物分子、抗体、核酸等,能达到对疾病靶向治疗的目的。然而目前水凝胶微针在关节炎、眼部疾病方面的研究较少,后期研究者可以加强这一方面的研究力度。当然针对水凝胶微针生物安全性和自身存在的问题,若能克服这些挑战,相信微针的智能化、便携化是大势所趋,诊断治疗一体化微针技术及可穿戴微针等将是微针领域未来的研究热点。
参考文献
详见中国药学杂志2021年6月第56卷第12期