热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
海洋冷泉中“海底微生物甲烷过滤器”的效率受上覆海水的扩散硫供应和深层水库的平流甲烷通量控制。高流体通量会降低硫酸盐的渗透深度,并将过滤器限制在靠近沉积物-水界面的非常狭窄的区域。在这里,我们介绍了一种新的通过(槽)系统的沉积物流,以模拟天然沉积物中流体/甲烷流和硫酸盐供应之间的平衡。槽能够在自然流态下对完整的沉积岩芯进行厌氧培养。除了传统的流入和流出取样外,还可以使用微传感器和根瘤菌沿沉积物岩芯监测地球化学参数。在第一次试运行中,在低(11.2 cm y–1)和高流体流量(112.1 cm y–1)条件下,对来自埃克恩费尔德湾(波罗的海)的两个含气沉积物岩芯进行了310天的培养和监测。与低流量(0.29 mmol m–2 d–1)相比,高流量下的甲烷厌氧氧化速率(AOM)高出一个数量级(3.07 mmol m–2 d–1),而甲烷流出量则高出一倍(分别为0.063和0.033 mmol m–2 d–1)。硫化物、硫酸盐、总碱度、pH值、氧化还原和其他参数的沉积物剖面提供了沉积物岩心生物地球化学反应性质和动力学的重要信息,包括甲烷营养、硫酸盐还原、碳酸盐沉淀和硫化物氧化。槽系统被证明是研究受平流流体输送影响的完整沉积物中生物地球化学参数时间演化的有效装置。
海洋沉积物蕴藏着地球上最大的甲烷储层,包括甲烷水合物(Burwicz et al.2011;Wall-mann et al.2012)。其中一部分甲烷从更深的地方迁移到冷泉处的沉积物表面,并被排放到水柱中。在水深较浅且排放率较高的地方,这种甲烷可以进入大气层,形成全球温室气体库。然而,大多数海洋甲烷已经被沉积物和水柱中的微生物过程所消耗(Reeburgh 2007)。
迄今为止,已经描述了微生物甲烷氧化的几种代谢途径,包括有氧途径和以硝酸盐(Ettwig et al.2010)、铁(Beal et al.2009)或硫酸盐(Boetius et al.2000)为末端电子受体的几种厌氧途径。甲烷与硫酸盐的厌氧氧化(AOM)是海洋沉积物中主要的甲烷氧化途径,在甲烷到达水柱之前消耗了80%以上的甲烷(Hinrichs和Boetius,2002年;Reeburgh,2007年)。
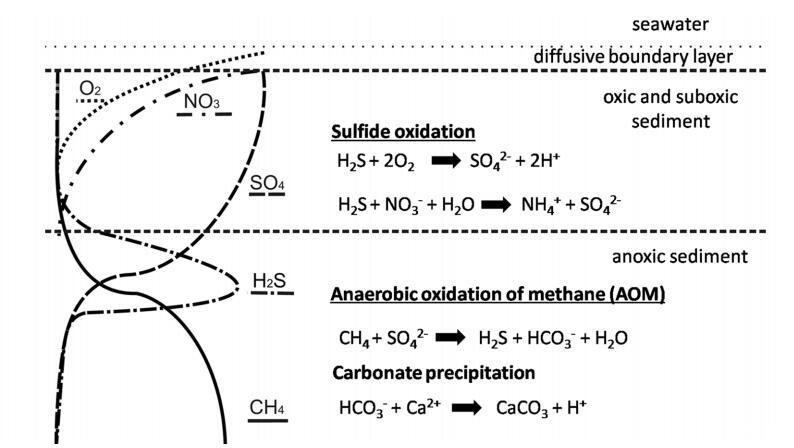
图1:。冷泉特征生物地球化学过程示意图。电子受体氧(虚线)、硝酸盐(宽虚线)和硫酸盐(虚线)的渗透。甲烷(实线)与渗流流体平流。硫化物(紧密虚线)和碳酸氢盐是由甲烷的厌氧氧化(AOM)产生的,由甲烷营养古菌和硫酸盐还原菌联合体介导。自生碳酸盐沉淀,硫化物被化能自养生物氧化。
在海洋陆架和大陆边缘,AOM活动主要出现在沉积物的上部10 m处。AOM区域(图1)通常被称为“底栖甲烷过滤器”(Sommer et al.2006)。AOM是由微生物联合体介导的,这些微生物利用硫酸盐作为电子受体。这些菌群由硫酸盐还原菌(SRB)和厌氧甲烷营养古菌(ANME)组成(Boetius et al.2000)。AOM财团减少硫酸盐并氧化甲烷,生成硫化物和碳酸氢盐(方程式1):
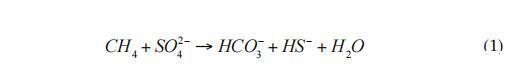
在一项新的研究中,Milucka等人(2012)提出了一种不同的反应机制。在这一途径中,ANME-2古菌通过产生元素硫作为中间产物单独氧化甲烷,进一步与二硫化物或其他多硫化物反应(式2):
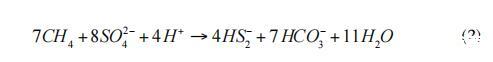
硫酸盐还原菌使用二硫化物,并以7:1的比例将其不成比例地转化为硫化物和硫酸盐(式3):
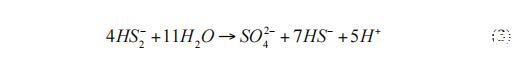
产生的硫酸盐可被古细菌再次用于甲烷氧化。通过组合式2和式3,得出式1的净反应。
在沉积物中,甲烷和硫酸盐同时耗尽的层位被称为硫酸盐-甲烷过渡带(SMTZ)(Iversen和Jørgensen 1985;Knittel和Boetius 2009)。在该区域,溶解无机碳(DIC)和硫化物(AOM的产物)显着增加。这两种产物也可以抑制反应。当孔隙水中存在高浓度的硫化物时,硫化物被认为是AOM反应本身的直接热力学抑制剂(Treude et al.2003;Zhang et al.2010)。在高AOM活性下,碳酸氢盐与钙反应形成自生碳酸盐(Peckmann et al.2001):该反应可通过降低沉积物的孔隙度或阻断流体通道间接抑制AOM(Treude et al.2003;Luff and Wallmann 2003;Kutterolf et al.2008;Karaca et al.2010),从而延缓甲烷的供应。
SMTZ的深度取决于硫酸盐的消耗率、下方甲烷的通量(Borowski等人,1999年),有时甚至取决于渗漏生物的活动(Cordes等人,2005年;Fischer等人,2012年)。除了甲烷营养,硫酸盐还原是海洋沉积物中有机物最重要的厌氧降解过程(Jørgensen 1978);因此,硫酸盐渗入沉积物的深度还可以由有机质输入和埋藏率决定(Borowski et al.1999)。在沿海沉积物中,由于有机碎屑硫酸盐还原对硫酸盐的消耗率很高,SMTZ通常位于海底以下几十米处,而在有机质贫乏的深海沉积物中,SMTZ的深度可能在地表以下几十米(Borowski 2004)。在有来自下方的平流甲烷供应的地方,如冷泉和泥火山,即使在深海环境中,SMTZ也可能非常浅,在前10 cm内显示硫酸盐耗尽(Treude et al.2003;Niemann et al.2006)。流体的平流输送产生了更强的甲烷通量,但也限制了硫酸盐的穿透深度。在这些地点,SMTZ深度的水平变异性通常很高,可以在分米尺度上变化(Treude et al.2003;Niemann et al.2006)。有时,即使在40 cm的横向距离内,也可以观察到底栖通量和AOM活动的强烈变化(Linke et al.2005)。化学合成渗漏动物群,如硫细菌垫、管蠕虫和蛤蜊,在硫化物上生长旺盛,可作为AOM活性和甲烷通量的指标(Sahling et al.2002;Torres et al.2002;Levin et al.2003;Treude et al.2003;Mau et al.2006)。
除了空间变异性外,流体通量和相关甲烷供应以及SMTZ深度的相应变化也可能暂时变化。短期流体流动波动可由阻塞的流体路径造成,例如通过天然气水合物的自发形成或碳酸盐的预循环(Luff et al.2004、2005),这迫使形成新的运移路径,或通过潮汐压力变化(Tryon et al.2002;LaBonte et al.2007;Røy et al.2008;Boles et al.2001)。
流体流动也可能在很大的时间和空间尺度上发生变化。地震可以引起强烈的流体流动脉冲或产生断层,从而成为流感病毒的新迁移途径(Tryon et al.2002;Hensen et al.2004;Aiello 2005;Hen-rys et al.2006;Mau et al.2007;Praeg et al.2009;Meister et al.2011)。地震也可能引发边坡破坏,随后导致质量浪费。大陆坡上的大规模浪费被怀疑会引发暴露的天然气水合物释放甲烷(Ranero et al.2008;Manga et al.2009)。据推测,甲烷通量的另一个长期变化是由全球变暖引起的。海底变暖将降低浅层海底天然气水合物的稳定性,并增加甲烷通量(Kvenvolden 1993;LaBonte 2007)。由于北冰洋受到全球变暖的强烈影响,并且由于低温,与其他海洋相比,天然气水合物的稳定性较浅,因此该区域可能是首批显示天然气水合物中与温度相关的甲烷释放的区域之一(Buffett和Archer 2004;Biastoch et al.2011)。
上述例子表明,从海底流出的甲烷通量在空间和时间尺度上都可能变化很大。了解底栖微生物甲烷过滤器对这些生长和活动变化的反应并不容易,因为很难在实验室模拟自然情况,也很难在现场进行适应。之前曾多次尝试使用流通系统研究AOM活动和动力学,即甲烷饱和海水连续流过沉积物的系统,以下段落简要总结了这些系统(直接比较见表1)。
Girguis等人(2003、2005)开发了一种连续流厌氧甲烷培养系统(AMIS),以测定ANME的生长速率。AMIS使用完整的沉积物岩心,从底部输送富含甲烷的海水(包括硫酸盐),从顶部输送不含甲烷的海水(包括硫酸盐)。在反应器中制备海水,以确保在大气压下甲烷浓度恒定。
在实验期间获得的子样本中确定AOM率。实验前后测定了ANME生物体的细胞丰度。ANME-2在低甲烷通量条件下的生长速率最高,而ANME-1在高甲烷通量条件下的生长速率更快。
Meulepas等人(2009年)在大气压力下使用了一个流动式膜生物反应器,该反应器充满沉积物,并由人工海水(20 mmol L–1硫酸盐)供应。甲烷通过生物反应器永久渗滤。速率由悬浮沉积物物质培养过程中13CH4的周转率确定。运行884天后,观察到非常高的AOM率(286μmol g干重–1 d–1)以及3.8个月的细胞倍增率。
Wegener和Boetius(2009)在大气压下使用流动培养反应器,以高流速的富含甲烷的人工海水培养沉淀泥浆。在恢复甲烷供应后,忍受了40天的饥饿时间,但没有导致活动减少。相反,硫酸盐浓度降低(1 mmol L–1)导致AOM活性下降50%。
Deusner等人(2010年)使用了加压系统(最大35 bar),该系统将溶解甲烷的浓度增加至70 mmol L–1,并使AOM速率比常压下的甲烷浓度高10-15倍。除了泵和压缩机之外,该系统还包括一个用于向介质中富集甲烷的有条件容器和一个用于培养沉淀泥浆的生物反应器。
Zhang等人(2010)还开发了一种高压/高甲烷流通系统,以防止孵化期间硫化物的抑制。该系统配有一个条件容器、高压泵和一个孵化ves-sel。进出口为硫化物测定提供取样。
Wankel et al.(2012)使用类似于AMIS的流通系统,底部温度梯度在90°C到顶部约22°C之间,以孵化热液喷口沉积物。完整的沉积物岩芯从下方供应富含甲烷(2.8 mol L–1)的缺氧海水介质(硫酸盐28 mmol L–1),流体流量约为330 cm y–1。AOM率是根据流入和流出中d13C甲烷和d13C DIC的自然浓度计算的。该研究表明,AOM在高温(90°C)下与硫酸盐还原脱钩,这可能与铁还原耦合。
开发上述流通系统和生物反应器是为了促进AOM生物体的最佳生长条件(Girguis et al.2003;Meulepas et al.2009),或通过单独调整系统来分析选定因素的影响(Wegener和Boetius 2009;Deusner et al.2010;Zhang et al.2010;Wankel et al.2012)。在大多数情况下,使用的是沉积物泥浆,而不是完整的沉积物岩心(表1)。然而,在天然甲烷渗漏处,条件与传统的人工设置非常不同。最重要的是,甲烷和硫酸盐从不同的方向以不同的速度供应:甲烷与来自更深来源的流体平流,而硫酸盐通过分子扩散从上覆水柱输送(Borowski et al.1996)。此外,甲烷供应的变化通常与流态的变化相关(Tryon等人,2002年;Tryon和Brown 2004年;Linke等人,2005年;LaBonte 2007年;Füri等人,2010年)。因此,海底甲烷过滤器不仅受到甲烷供应量增加的挑战,还受到电子受体(即硫酸盐)穿透深度变浅的进一步压力(Niemann et al.2006)。最后,天然(完整)沉积物与实验室沉积物泥浆(均质沉积物-海水混合物)具有非常不同的特性(例如,孔隙度、渗透率、浓度梯度)。迄今为止,Girguis et al.(2003)和Wankel et al.(2012)的水流系统是唯一使用完整沉积物岩心的系统。然而,该系统缺乏技术可行性,无法监测堆芯内的生物地球化学随时间的发展。因此,本研究的目的是开发一个新系统,该系统能够对AOM活动进行时序研究,并在整个岩芯长度上,将不同流体/甲烷流动状态下完整沉积物岩芯中的生物地球化学参数关联起来。槽系统有助于甲烷和硫的自然供应,并在实验期间监测生物地球化学梯度。在首次使用波罗的海Eckernförde湾的含气沉积物应用该系统时(例如,Treude et al.2005),我们重点关注以下研究问题:
底栖微生物甲烷过滤器和地球化学梯度如何对变化的流体和甲烷流动状态作出反应,以及达到稳定状态的反应时间有多长?
在甲烷供应增加和硫酸盐渗透减少的情况下,底栖甲烷过滤器去除甲烷的效率如何?
插槽系统
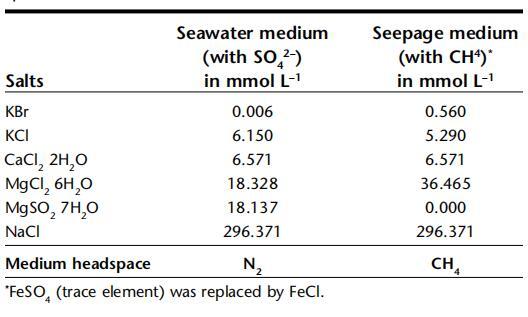
槽系统设计用于模拟原状沉积物岩心中的自然渗流条件,其中甲烷从底部平流输送,硫酸盐从岩心顶部扩散供应。根据Widdel和Bak(2006),用于提供电子受体和供体的液体由硫酸盐还原菌的缺氧海水培养基组成。缺氧硫酸盐介质(SO42–浓度19 mmol L–1,盐度22 psu,根据研究地点的自然浓度:Whiticar 2002;Treude et al.2005),用于模拟“海水”条件,即允许从沉积物表面扩散硫酸盐供应,无甲烷。甲烷富集培养基(CH4浓度约930μmol L–1,盐度22 psu),用于模拟下方的“渗流”条件,无硫酸盐。在下文中,这两种介质根据其流动方向和成分被称为“海水”和“渗流”介质。海水介质从带有氮气顶空的单个储液罐中输送(图2)。为了提供渗流介质,该系统由两个相连的储层组成,其中一个储层为氮气(储层1),另一个储层为甲烷(储层2)。储层2通过蠕动泵将富含甲烷的介质直接输送至沉积岩芯底部(详情见下文)。一旦储层2中的介质液位降低,产生轻微的欠压,就从储层1中补充新介质(氮气顶空)。在储层2中,来自储层1的介质富含甲烷。通过让进入的介质通过甲烷顶空下落,增强了甲烷顶空与介质之间的平衡。
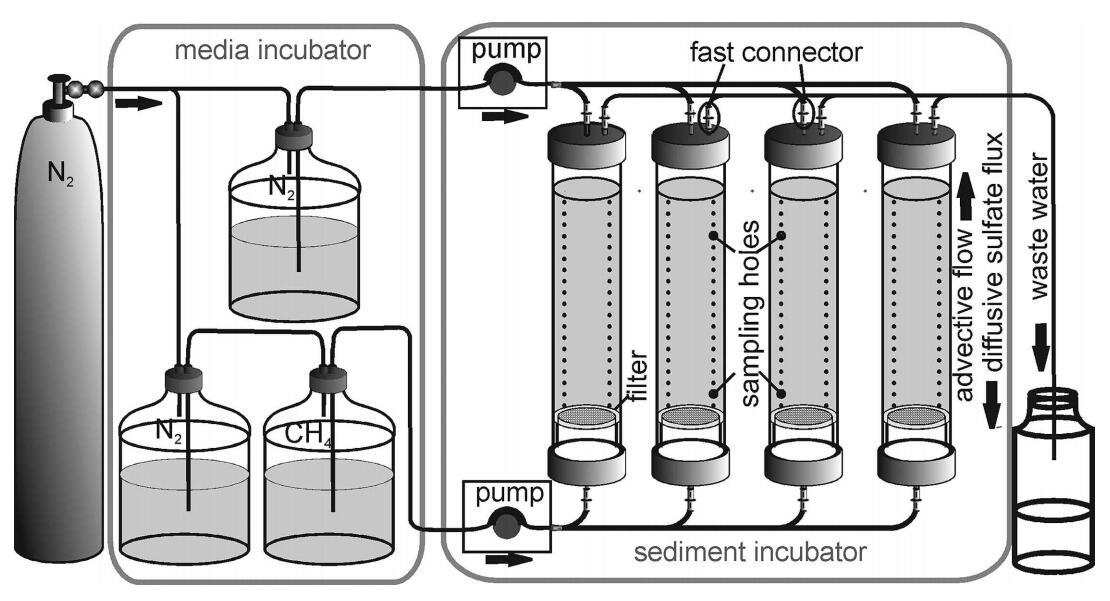
图2:。插槽系统示意图。将培养基储液罐储存并在10°C的冰箱柜中冷却。培养基从顶部进入堆芯,模拟缺氧海水。富含甲烷但不含硫酸盐的下部介质从底部进入岩芯,模拟流体渗流。CH4储层中的渗流介质富含甲烷。所有介质均通过泵和管道输送。所有磁芯均配有快速连接器,以避免断开时空气侵入,并配有三行21个硅密封孔用于取样。沉积物芯下方的玻璃纤维过滤器防止沉积物流失到槽系统的下部。流出的废水(顶部)收集在一个瓶子中。
为了追踪岩心内渗流介质的迁移,我们使用溴作为惰性示踪剂。虽然溴在渗流介质中以标准浓度(560μmol L–1)存在,但在海水介质中仅以痕量浓度(6μmol L–1)存在。Resazurin被用作两种介质中氧污染的指示剂(Visser等人,1990年)。有关介质组成的更多详细信息,请参阅下文(“实验设置”和表2)。所有培养基均储存在10°C的冰箱柜中,避光保存。
表2:。槽系统中使用的两种不同介质的盐浓度。含硫酸盐的海水介质从顶部输送,含甲烷的渗流介质从底部输送,不含硫酸盐。在最后一行中,表示介质顶部空间的气体。
在该系统中,介质由蠕动泵(Medorex TL/10E,最小/最大泵容量0.1μL min–1/400μL min–1)使用Santropen(可高压灭菌、高柔性、高抗腐蚀)管(内径0.5 mm,外径1.6 mm)输送。在氮气供应(气罐)、介质储罐和泵之间以及泵和沉积物芯之间,使用了Iso Versenic(可高压灭菌、非常耐腐蚀、非常低的气体渗透性)管(内径1 mm,外径3 mm)。管接头由聚丙烯制成(Brandt GmbH)。
聚碳酸酯芯衬(气密,总长30 cm,内径6 cm,外径6.8 cm;图3D)配有三条垂直的取样孔线(每条线21个孔,直径4 mm,取样孔之间的距离5.8 mm),并用无残渣硅(Aquasil,Probau)密封。内衬在顶部和底部都用聚氯乙烯(PVC)制成的盖子封闭(图3A、3B)。这些盖子(顶部和底部)有一个带有分配器容器的流入管(图3B)。流出口(仅顶盖)位于该容器后面。丁腈橡胶(NBR)O形圈位于盖的内边缘,用于密封盖和衬里之间的连接。在衬里的底部,固定一个过滤器支架(图3C),以固定一个玻璃纤维过滤器(直径6 cm,孔径5μm)。过滤器防止沉积物颗粒进入分配器容器。沉积物芯通过快速连接器(聚丙烯,较冷的产品)连接到泵系统,使管道易于连接和断开,无需氧气侵入。泵和泵芯储存在冰箱中,温度为10°C,且在黑暗中。有关SLOT系统中所用沉积物岩心的现场取样和实验设置的详细信息,请参阅下面的“现场取样(Eckernförde Bay)”和“实验设置”。
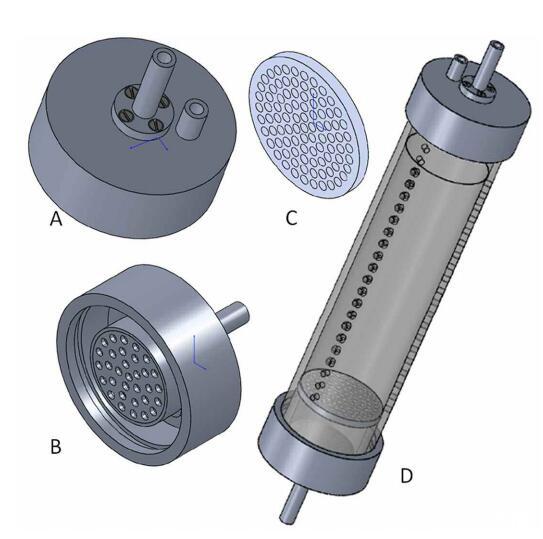
图3:。槽衬套的单个组件。(A)顶盖(外部视图,PVC),带进水管(中、长、分配容器未显示)和出水管(短、右),(B)底盖,带进水管和分配容器(PVC),(C)带开口的过滤器支架(PVC),(D)带三行取样孔的槽内衬(聚碳酸酯),内部配备过滤器支架(聚碳酸酯),顶盖(进出口),和底盖(流入口)。
插槽系统孵化期间的取样程序和分析
在槽芯孵化期间,在孵育过程中的几个时间点,使用硅填充取样孔进行rhi-zons孔隙水亚取样(Meijboom和Noordwijk 1991)或水平微传感器测量(pH、氧化还原电位、硫化物;Revs-bech和Jørgensen 1986)(硫化物在32、80、129、169、234、303和360天后;pH在169、234、303和360天后;氧化还原电位在32、129、169、303和360天后;总培养时间376天)。
孔隙水取样
对于使用根进行的孔隙水取样(图4C和4D),小心地从取样孔中去除硅,并将用高压盐水(salin-ity 22 psu)预湿的根(根际,CSS-F,长5 cm,直径2.5 mm,孔径0.2μm)缓慢推入沉积物中。之后,在孔周围用无残留硅(Aquasil、Probau)密封根瘤,并在整个培养时间内保持在沉积物芯内。对于重复的孔隙水取样,从根中去除前0.5 mL残留水并丢弃。随后,对1.0-1.5 mL孔隙水进行取样(3 mL luer lock注射器,Becton,Dickinson and Company),并将其转移至2 mL塑料瓶(安全锁管,2 mL,Eppendorf)中,用于随后的总碱度(TA)、硫酸盐、溴化物和氯化物分析(见下文)。根据Seeberg-Elverfeldt et al.(2005),我们计算,最多只能对3 mL孔隙水进行取样,以避免相邻深度段的交叉取样。

图4:。槽芯取样程序:(a)通过带有pH针传感器(左)和参考针电极(右)的硅填充取样孔进行微传感器测量;(b)用硼硅酸盐注射器和快速接头进行流出取样;(c)核心底水中的微传感器和根线;(d)穿过硅密封取样孔的针状传感器;(e)通过取样孔使用根线进行孔隙水取样。
在使用根瘤菌进行孔隙水取样之前,使用硼硅酸盐玻璃注射器(luer,5 mL,Poulton&Graf GmbH)对流出介质(图4B)进行取样,流出介质位于系统顶部,并通过一根等速管(5 mm长,3 mm直径)连接到快速耦合器。两种流入介质(“海水”和“渗流”)直接在将管道连接至岩心的快速连接器之前,使用管接头和硼硅酸盐注射器(见上文)进行取样。对于甲烷样品,将2 cm3培养基转移到含有5 cm3 2.5%(w/v NaOH)的10 mL血清瓶中。立即用丁基橡胶塞关闭小瓶。剩余的样品体积(约1.5-2 cm3)储存在塑料瓶(安全锁管,Eppendorf,2 mL)中,用于总碱度滴定和离子分析。
微传感器分析
我们使用钢针传感器对沉积物岩心中的地球化学参数(pH、氧化还原电位、硫化物)进行微传感器分析(Revsbech和Jørgensen 1986)(图4A、D和E)。针式传感器较不易损坏,并且很容易通过硅填充孔穿透芯衬套。然而,这种类型的传感器通常比普通玻璃传感器有更长的响应时间,这取决于温度、传感器年龄和沉积物类型。由于沉积物芯的温度接近10°C(测量期间通过冷包稳定),并且必须在室温下进行测量,因此传感器必须在每个测量点适应新的温度,这增加了响应时间。因此,在穿过取样孔后,允许传感器在5到15分钟之间进行调整,直到宣布某个值有效(至少为响应信号t90的90%)。测量以约2 cm的间隔进行,即每隔一个采样孔进行一次,但沉积物-水界面除外,该界面上的测量直接在界面上方和下方进行。使用微电极公司(MI 411 B,量规20)的微型传感器测量pH值。对于三点校准(pH 4.01、6.89和9.18),使用默克公司的标准pH缓冲液。使用Unisense、Den-mark(RD-N,尖端直径0.8 mm)的传感器或氧化还原针传感器(MI-800,25号仪表,微电极公司)测量氧化还原电位。用pH值为4和7的缓冲液中饱和二氢喹啉溶液的两点校准对传感器进行校准。传感器手册提供了与标准氢电极(SHE)相关的氧化还原电位(mV)。硫化氢(H2S)由丹麦Unisense的针式微型传感器测量(H2S-N,尖端直径0.8 mm)。传感器通过6种标准NaS溶液(0、100、200、500、1000、2000μmol L–1)进行校准,这些溶液在无氧磷酸盐缓冲液(>4 pH)中制备,TiCl含量为10%v/v。根据Jeroschewski et al.(1996),使用H2S浓度、pH值、盐度和温度计算总硫化物浓度(包括H2S、HS-和S2-)。对于缺失的pH值曲线(运行32、80、129天),使用7.5的pH值(培养基制备pH值)。
实验终止和岩心切片
在实验结束时,用根瘤菌再次对孔隙水进行取样(见上文)。这一次,提取了更大体积(每个取样孔平均约4.3 mL)的铵、硝酸盐和硫化物样品(见下文分析)。拆除顶盖和底盖后,将芯放在挤出机上(直径5.8 cm)。将两个聚碳酸盐亚岩芯(长26 cm,内径2.5 cm,外径2.6 cm)推入岩芯,以测定硫酸盐还原和甲烷厌氧氧化(AOM)速率(见下文分析)。尽管子岩芯仍在沉积物中,但在挤出机的帮助下,将沉积物岩芯推到衬里外,并逐步切成1 cm的甲烷取样间隔(2 cm3)和2 cm的孔隙度间隔(约1.5 cm3)、总CNS(孔隙度子样本)和总有机碳(TOC,孔隙度子样本)(见下文分析)。在2 cm的间隔内采集额外的样本,用于未来的工作,如催化报告者沉积荧光原位杂交(CARD-FISH,0.5 cm3)、脂质生物标记物(~3 cm3)和RNA/DNA(2 cm3)分析。