热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
2.4质膜K通道抑制剂对沙冬青和绿豆幼根根冠细胞膜电位的影响
TEA是一种常用的K通道抑制剂,当浴液中含6 mmol/L TEA就能很快阻断全细胞内向K电流。本研究考察了TEA对活体植物细胞膜电位的影响(如图5)。图5A为对照,即未经TEA处理,直接加入100mmol/LNaC1后膜电位变化时程图;图5B是加入TEA 10 min后,再加入100 mmol/L NaC1的膜电位变化时程图。
如图5所示,利用TEA抑制K通道以后再进行NaC1处理时,绿豆膜电位去极化虽表现出两个阶段,但变化不如对照中剧烈。通过计算两种处理下膜电位去极化的斜率,我们发现,沙冬青和绿豆膜电位去极化第2阶段的斜率都要小于直接进行NaC1处理下的(表5),这应该是细胞内的净阳离子数减少所致。而造成这一现象的原因我们认为是内向K通道被抑制以后,在一定程度上限制了Na跨膜进入胞内。通过比较TEA对沙冬青和绿豆幼根伸长生长的影响,我们发现TEA与NaC1共同存在时,幼根伸长生长受到的抑制程度要小于单独进行NaC1处理的结果。这也进一步证明了TEA的存在能够在一定程度上减轻NaC1对植物造成的伤害,因此我们推测内向K通道可能参与了Na的跨膜转运过程。

图5含TEA的培养液与对照液中100mmol/LNaC1对沙冬青和绿豆细胞膜电位的影响
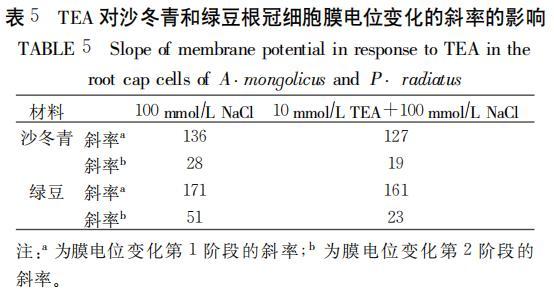
表5 TEA对沙冬青和绿豆根冠细胞膜电位变化的斜率的影响
3讨论
在揭示植物生理生化机理的过程中,光合作用的研究给了我们启示。20世纪60年代,人们在研究光量子的原初受体及原初供体时提出了光化学反应即光合原初反应,此概念的提出大大促进了随后对光合作用机理的研究进程n。因此,我们探讨植膜电位的改变可以启动电压敏感的离子通道,并引发一系列下游事件(如质膜H-ATPase活性的变化)。
前人研究表明,阴离子对膜电位的影响很小n。本实验进行的不同盐处理所引入的阴离子均为Cl一,因此,处理后膜电位的变化可以认为是由于外界加入的一价阳离子Na、K和Li的种类和浓度差异所引起的。研究结果表明,NaC1、KC1和LiC1都能够引起植物细胞膜电位升高(去极化),且膜电位的响应很快,几秒钟内就完成去极化的过程,这一过程主要包括两个阶段。综合分析膜电位的变化特点,得出如下结论:
1)膜电位的变化能够更直观地反映植物吸收盐离子的特征与差异。对于抗性差异比较大的沙冬青和绿豆来说,无论外界阳离子的种类和浓度如何变化,在相同盐胁迫条件下,沙冬青根冠细胞膜电位变化幅度都要小于绿豆。究其原因,我们认为在盐胁迫下沙冬青具有更强的自我调节细胞内外离子平衡的能力。通过调节胞内外离子的跨膜转运来平衡盐分引起的细胞膜电位的去极化。
2)离子的理化性状(离子半径和价数)影响植物细胞膜电位的变化。Li、Na、K同为碱金属元素,因其在水溶液中的水合离子有效半径大小不一,在根自由空间的迁移速率就不同(K在根自由空间的迁移速率最大,Na次之,lJi最小),从而导致相同时问到达细胞膜表面的离子数不同,所以离子引起的膜电位变化也存在差异。
质膜H-ATPase是植物和真菌体内的一个关键酶。植物体内许多膜结合转运蛋白都直接或间接地由质膜H-ATPase提供能量。植物在细胞水平抵抗Na毒害的主要方式是把细胞质中Na排除出去,一方面通过限制被动方式的Na内流,另一方面通过离子泵的作用把胞质内Na释放到胞外基质或液泡内,并认为上述过程是由质膜H-ATPase和Na/H反向运输蛋白共同完成。从本实验来看,当质膜H-ATPase活性被抑制后,进行NaC1处理,由于此时质膜H-ATPase不能水解ATP驱动质子运出胞质,不能为Na/H反向运输蛋白提供足够的能量将多余的Na泵到胞外基质或液泡中,使得细胞质中积累的H、Na过多,导致膜电位去极化增强。因此本研究结果表明,质膜H一ATPase参与了沙冬青和绿豆根冠细胞膜电位在盐胁迫时的原初响应,质膜H-ATPase在减轻盐胁迫对植物细胞的伤害方面具有一定作用。
另外,TEA抑制内向K通道以后,再进行NaC1处理,单位时间进入细胞内的净阳离子数减少,导致膜电位去极化程度降低。通过前期比较TEA对沙冬青和绿豆幼根伸长生长的影响,我们发现TEA能够在一定程度上减轻NaC1对植物造成的伤害,因此我们推测K通道可能参与了Na的跨膜转运,是Na进入细胞的途径之一。
膜电位的变化更直观地反映了植物吸收盐离子的特征与差异,利用微电极测定膜电位为研究植物对盐胁迫的快速响应提供了新方法,为在膜水平上研究植物的耐盐性开创新方向。