热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
研究简介:富含黑素体的偏振上皮细胞的视网膜色素上皮(RPE)位于视网膜感光层和布鲁赫膜之间,靠近脉络膜。RPE损伤与退行性视网膜疾病的发展有关,例如糖尿病视网膜病变(DR)和年龄相关性黄斑变性(AMD),这两种疾病都是导致失明的主要原因。光感受器与RPE、布鲁赫膜和脉络膜的相互作用调节11-cis视网膜和光感受器外节(OS)的更新、神经视网膜和循环之间的物质交换,并形成外节血视网膜屏障(OBRB)。视杆细胞OS是一种参与视觉信号转导的修饰纤毛。特别是该操作系统包含大约2000个堆叠的膜盘,它们经历着受光调节的持续更新过程。当RPE不断吞噬OS尖端盘时,新的盘在纤毛基部形成。OS吞噬作用涉及αvβ5整合素受体、粘着斑激酶(FAK)和Mer酪氨酸激酶(MerTK)。椎间盘的形成仍不完全清楚,它涉及纤毛旁边外翻形成囊的基底膜的合成,以及通过鞭毛内转运蛋白(IFT)掺入内部节段合成的椎间盘蛋白。视杆细胞的凋亡比视锥细胞更容易受到损伤,进而导致视锥细胞损失,损害高敏锐度视力。视杆细胞分泌一种营养锥活力因子,这种因子是在截短的硫氧还蛋白样蛋白中发现的。
为了阐明DR的发病机制,了解RPE和视杆OS之间的相互作用似乎至关重要,考虑到为了维持光转导的能量需求,OS表现出自己的氧化代谢。由于还没有研究调查这一主题,本研究工作旨在评估OS和RPE之间是否存在串扰,从而导致外视网膜累积氧化损伤。因此研究人员研究了未氧化(UOx)或氧化(Ox)rod OS吞噬作用对在正常(NG)或高葡萄糖(HG)条件下生长的ARPE-19细胞的影响。
Unisense微呼吸系统的应用
在37°C的密闭室中通过微呼吸氧电极(Unisense Microrespiration,Unisense A/S)评估耗氧率(OCR)。在实验中,将2×105 ARPE-19细胞重新悬浮在磷酸盐缓冲液(PBS)中,并用0.03 mg/mL毛地黄皂苷透化1分钟。总共添加10 mM丙酮酸加5 mM苹果酸或20 mM琥珀酸,分别刺激由复合物I、III和IV或复合物II、III和IV组成的呼吸途径。这两种情况下,都添加了0.1 mM ADP。对于杆OS,使用50μg总蛋白,并使用0.1mM NADH和0.1mM ADP作为呼吸底物。
实验结果
数据表明RPE和OS光感受器之间存在串扰,这在DR发病机制中起决定性作用。这些数据还支持了新的发现,即DR的首要推动因素是对视网膜外层神经元的氧化损伤。后者反过来会对RPE造成氧化损伤,并最终对血管系统造成氧化损伤。数据还表明单独的ARPE-19细胞可能并不是研究外视网膜氧化应激作用的详尽模型。研究人员认为评估几种细胞类型之间的相互作用是必要的。目前的实验模型可以突出体内病理条件下可能发生的潜在现象,为未来DR的预防性干预开辟新的视野。然而有必要在动物模型中进行进一步的体内实验,以证实关于高血糖条件下RPE和rod OS之间氧化应激产生中的串扰的体外数据。
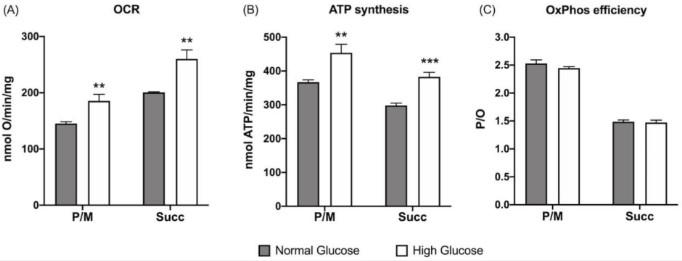
图1、生长培养基中葡萄糖浓度对ARPE-19细胞有氧代谢的影响:(A)耗氧率(OCR);(B)有氧ATP合成;(C)P/O值作为OxPhos效率标记。在存在丙酮酸加苹果酸(P/M)或琥珀酸(Succ)的情况下评估了有氧代谢,以分别刺激复合物I、III和IV以及复合物II、III和IV的途径。灰色柱代表在5.6 mM葡萄糖(正常葡萄糖,对应于通常用于生长这些细胞的葡萄糖浓度)下生长的ARPE-19细胞获得的数据,白色柱代表在高葡萄糖培养基(25 mM)中生长的相同样品。
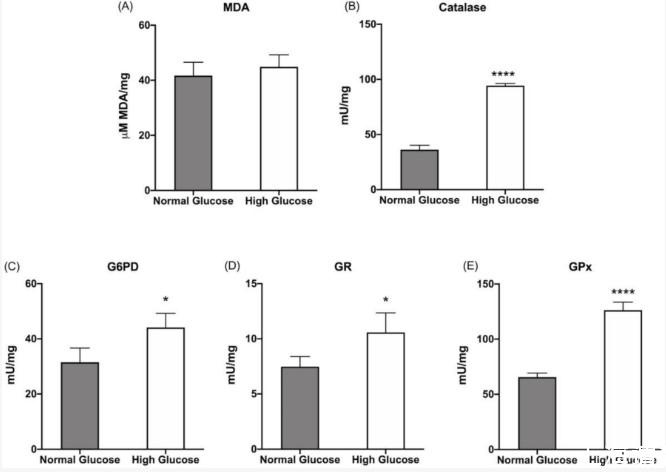
图2、在正常或高葡萄糖培养基中生长的ARPE-19细胞中的脂质过氧化和抗氧化防御:(A)丙二醛(MDA)浓度作为脂质过氧化的标记;(B)过氧化氢酶活性;(C)葡萄糖6-磷酸脱氢酶(G6PD)活性;(D)谷胱甘肽还原酶(GR)活性;(E)谷胱甘肽过氧化物酶(GPx)活性。所有测试的酶都参与细胞抗氧化防御。灰色柱代表在5.6 mM葡萄糖(正常葡萄糖,对应于通常用于生长这些细胞的葡萄糖浓度)下生长的ARPE-19细胞获得的数据,白色柱代表在高葡萄糖培养基(25 mM)中生长的相同样品。
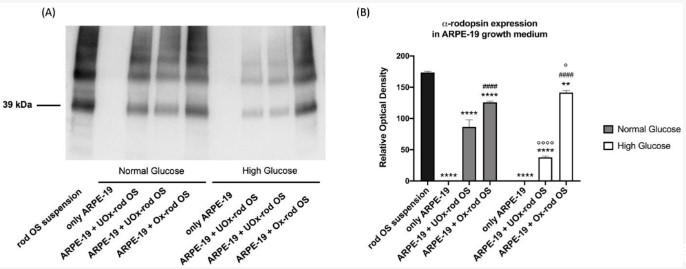
图3、ARPE-19细胞生长培养基中的视紫红质数量作为细胞吞噬未氧化或氧化的视杆细胞能力的标志。(A)与未氧化(UOx)或氧化(Ox)视杆OS孵育5.5小时后ARPE-19细胞生长培养基中的视紫红质信号。补充图S2报告了整个WB信号,包括分子量(MW)标记。(B)视紫红质单体信号(39 kDa)的光密度分析。黑色柱代表孵育前rod OS悬浮液中视紫红质的浓度;灰色和白色柱分别代表NG和HG条件下的视紫红质浓度。数据表示为平均值±SD,代表四次独立重复(n=4)。
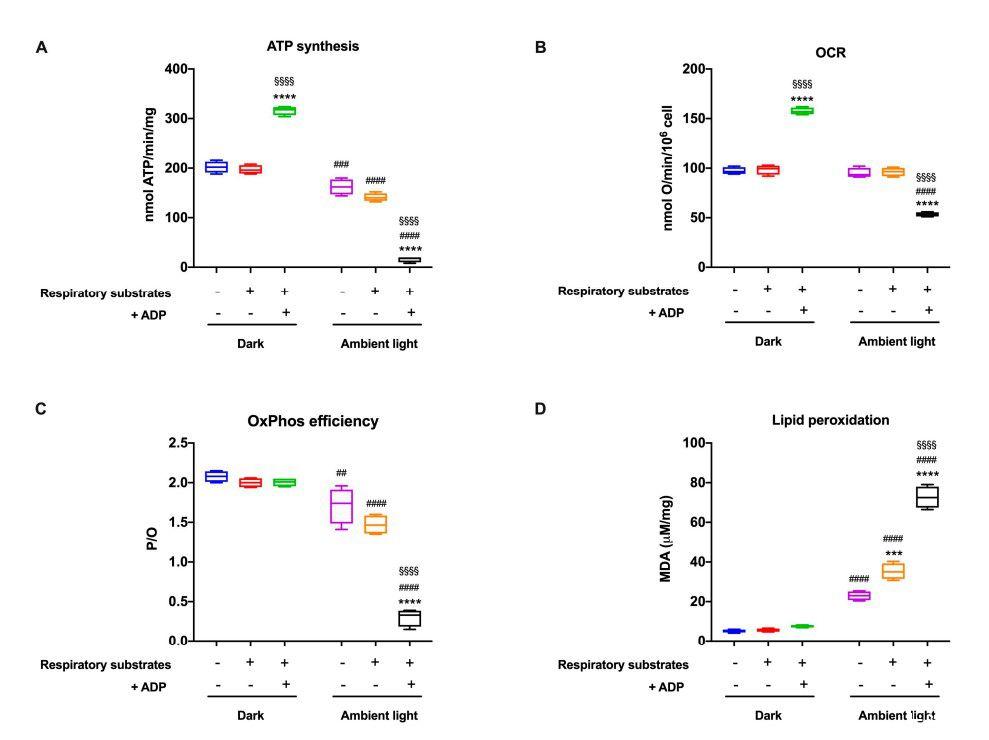
图4、ATP合成、耗氧率、氧磷效率和脂质过氧化。图所示的所有数据均已获得从与呼吸底物(0.6 mM)预孵育或未孵育的牛棒状OSs中提取NADH和20 mM琥珀酸盐/或0.1 mM ADP,并在黑暗中维持(A)通过F1Fo-ATP合成ATP。合成酶和(B)耗氧量(OCR);在两个实验中都是0.1 mM加入NADH诱导OCR和ATP合成。(C)P/O值,OxPhos效率的标志,计算为合成ATP与消耗氧气的比值。(D)MDA含量作为脂质过氧化标志物。数据具有四个独立重复的代表性(n=4)。
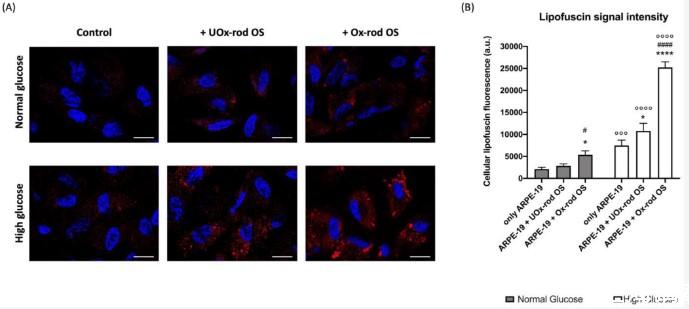
图5、在正常或高葡萄糖培养基中生长并与UOx-或Ox-rod OS一起孵育的ARPE-19细胞中脂褐素的积累。(A)代表性共焦图像,报告在正常葡萄糖(NG)和高葡萄糖(HG)条件下生长并与UOx-或Ox-rod OS一起孵育的ARPE-19细胞中细胞质脂褐质积累(红色信号)。蓝色信号对应于用DAPI染色的细胞核。条形刻度对应于10μm。(B)脂褐质荧光信号的强度。灰色柱代表在NG条件下生长的ARPE-19细胞获得的数据,白色柱代表在HG条件下生长的相同样品。
结论与展望
视网膜色素上皮(RPE)功能障碍与多种以视网膜变性为特征的疾病有关,例如糖尿病性视网膜病(DR)。然而外层视网膜神经元也参与损伤触发。研究人员评估了RPE和光感受器之间在引发和维持RPE氧化损伤方面可能存在的串扰。使用ARPE-19细胞作为人类RPE模型,在正常(NG,5.6 mM)或高葡萄糖(HG,25 mM)和未氧化(UOx)或氧化(Ox)哺乳动物视网膜杆外节中生长。ARPE-19细胞在NG和HG环境中都能有效吞噬rod OS。然而在HG中,与未处理的细胞和UOx-rod-OS处理的细胞相比,用Ox-rod OS处理的ARPE-19细胞积累了MDA和脂褐素,并表现出LC3、GRP78和caspase 8表达的改变。数据表明早期氧化损伤可能源自光感受器,随后延伸至RPE,这为视网膜变性仅取决于RPE氧化还原变化的观点提供了新的视角。