热线:021-56056830,66110819
手机:13564362870


热线:021-56056830,66110819
手机:13564362870
研究简介:肿瘤微环境的酸度从根本上影响癌症和基质细胞的功能、它们的相互作用以及形成恶性进展的选择压力和适应过程。肿瘤微环境的酸碱组成对预后预测和新治疗方法的开发具有相当大的前景,但我们仍然缺乏合理设计靶向干预措施的机制洞察力。CA9还具有至少部分独立于其碳酸酐酶活性的促癌作用,涉及细胞粘附功能,并且可能受到细胞外结构域脱落的影响。尽管CA9和CA12是乳腺癌的预后标志物和拟议的药理学靶点,但这些和其他碳酸酐酶对特定乳腺癌分子亚型的影响仍不清楚。在代谢和增殖活性、免疫原性和潜在致癌途径不同的肿瘤中,碳酸酐酶如何影响癌细胞和基质细胞(包括脉管系统和免疫系统)之间的相互作用。离体肿瘤脉管系统和免疫细胞功能的酸碱依赖性变化是显著的,但它们在肿瘤微环境中的后果需要进一步研究。实体癌组织内明显的扩散限制——结合碳酸酐酶活性的局灶性积累和pH介导的酸碱转运蛋白变构调节—导致从根本上影响肿瘤生物学的分隔pH动力学。因此为了解决碳酸酐酶在致癌和癌症进展过程中的功能贡献,在体内或在保持逼真的3维结构和相关基质成分的离体条件下研究癌组织至关重要。在这里研究人员通过以下方式实现这一目标:研究从人类和小鼠乳腺癌组织和匹配的正常乳腺组织中新鲜分离的类器官中碳酸酐酶的表达和功能;在小鼠乳腺癌模型中的体内研究,以及评估与临床和病理信息相结合的人体体积和单细胞转录组数据。
Unisense微电极分析系统的应用
首先向荷瘤小鼠腹膜内注射50 mg/kg乙酰唑胺或载体来评估体内急性碳酸酐酶抑制的pH值后果。然后5分钟后,小鼠注射氯胺酮和甲苯噻嗪以诱导麻醉。老鼠被放在加热垫上;总共30分钟后,通过一个小切口暴露肿瘤,并使用玻璃微电极(pH-500;Unisense,丹麦),以记录进入肿瘤的1毫米步进过程中的pH值。参比电极放置在腹腔内。报告了腹膜表面、肿瘤4毫米深度以及遇到的酸性最强的肿瘤位置(表示为肿瘤“核心”)的pH值。
实验结果
碳酸酐酶——尤其是细胞外亚型CA4、CA6、CA9、CA12和CA14——在人类和小鼠乳腺癌发生过程中发生了强烈的表达变化。在基底样/三阴性乳腺癌患者中,细胞外碳酸酐酶表达升高对生存有负面预测,而令人惊讶的是,细胞外碳酸酐酶对HER2/ErbB2富集乳腺癌患者的生存有积极预测。碳酸酐酶抑制减弱细胞净酸排出和细胞外H+从人和小鼠乳腺癌组织的扩散受限区域到外周和灌注良好区域的消除。在体内提供的碳酸酐酶抑制剂乙酰唑胺可酸化ErbB2诱导的小鼠乳腺癌微环境,限制肿瘤免疫浸润(CD3+T细胞、CD19+B细胞、F4/80+巨噬细胞),降低炎性细胞因子(Il1a、Il1b、Il6)和转录因子(Nfkb1)表达,并加速肿瘤生长。支持碳酸酐酶的免疫调节作用,与富含HER2的乳腺癌细胞外碳酸酐酶高表达相关的患者生存获益取决于肿瘤炎症特征。乙酰唑胺可降低乳腺组织和血液中的乳酸水平而不影响乳腺肿瘤灌注,这表明抑制碳酸酐酶可降低发酵糖酵解。碳酸酐酶通过加速癌细胞和间质间隙的净H+消除来提高乳腺癌中的pH值,在ErbB2/her2驱动的乳腺癌中提高免疫浸润和炎症,限制肿瘤生长并提高患者生存率。

图1、在人类乳腺癌组织中,线粒体CA5A和CA5B在细胞类型中普遍表达,而非线粒体碳酸酐酶亚型在癌症上皮细胞和内皮细胞中占主导地位,除了CA7仅由癌症相关的成纤维细胞和骨髓细胞表达。A)总体碳酸酐酶表达强度显示为t-SNE图(左)和相应的成簇细胞类型(右)。B)图显示了人乳腺癌中碳酸酐酶表达的细胞类型特异性模式。报告的单细胞测序数据涵盖24489个癌上皮细胞、6573个癌相关成纤维细胞、7605个内皮细胞、35214个T细胞、3206个B细胞和9675个髓样细胞。数据是从Broad Institute托管的在线单细胞门户中提取的。C图显示了294个乳腺癌样本中碳酸酐酶的蛋白质表达水平。
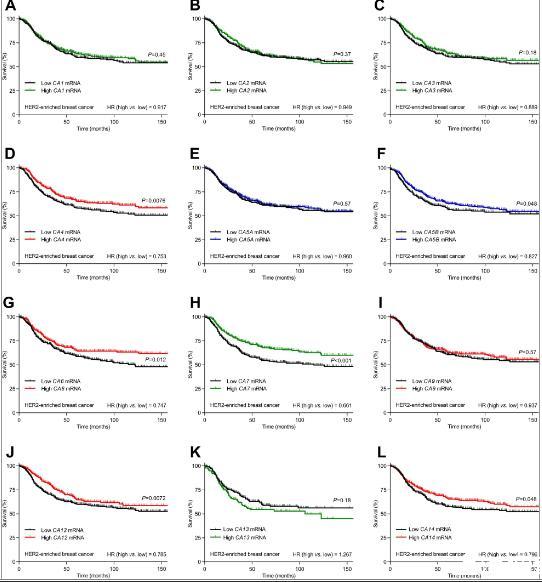
图2、具有已知细胞外表达的碳酸酐酶亚型CA4、CA6、CA12和CA14、具有已知线粒体表达的CA5β和具有已知细胞溶质表达的CA7可积极预测富含HER2的乳腺癌患者的预后。A–L富含HER2的乳腺癌患者(n=358–860)的生存曲线根据每种碳酸酐酶亚型的mRNA表达进行分层。曲线的颜色编码区分具有已知细胞外或分泌(红色)、细胞溶质(绿色)和线粒体(蓝色)表达的碳酸酐酶亚型。
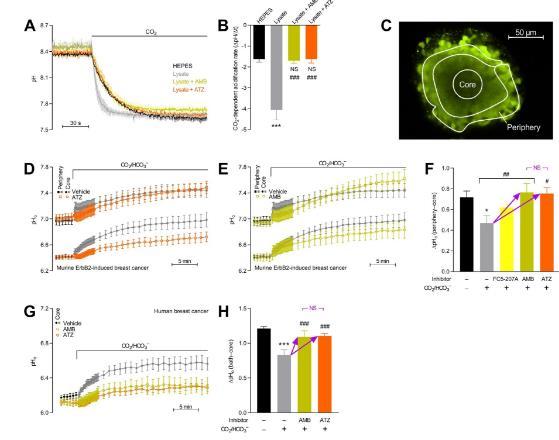
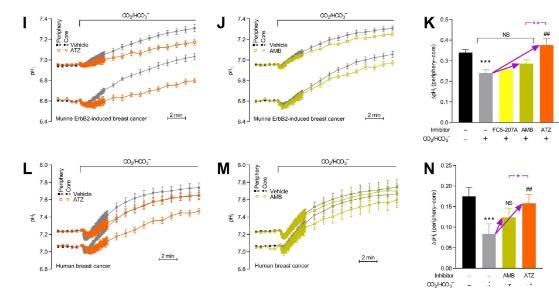
图3、碳酸酐酶从根本上改变了乳腺癌组织中的pH动力学,抑制了癌细胞的净酸排出,并降低了从核心到外周的间质净H+消除。(A)响应于将CO2应用于不含HEPES缓冲CO2/HCO3的溶液的平均pH曲线;B量化酸化速率。(C)在装有pH敏感荧光团羧基SNARF-1的类器官的赤道平面上获取的共聚焦图像。白色描绘说明了用于量化类器官核心和外围pH动力学的示例性感兴趣区域。DH细胞外(表面)pH动力学响应小鼠ErbB2诱导的急性暴露(D–F)和人类(G+H,)乳腺癌类器官对CO2/HCO3–相对于没有CO2/HCO3–的初始平均值。图F显示了类器官核心和外围之间的量化pHo差异,以及它们如何被CO2/HCO3和碳酸酐酶抑制修饰。图H显示了关于类器官核心和实验之间pHo差异的类似信息。IN响应小鼠ErbB2诱导的急性暴露的细胞内pH动力学(I–K,n=6–26)和人类(L-N,n=8)乳腺癌类器官对CO2/HCO3–相对于没有CO2/HCO3–的初始平均值。
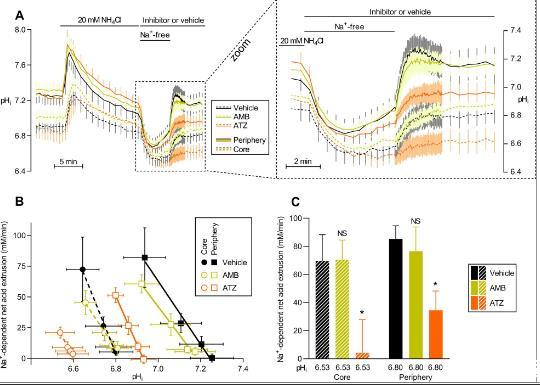
图4、细胞内碳酸酐酶的抑制降低了小鼠ErbB2诱导的乳腺癌组织中细胞净酸挤出的能力。A在NH 4+前脉冲诱导的细胞内酸化和随后的恢复过程中,新鲜分离的乳腺癌类器官中pH i的平均曲线(n=6)。使用乙酰唑胺(ATZ,100µM)、4-氨基乙基)苯磺酰胺(AMB,30µM)或等量的DMSO载体进行实验。面板的右侧部分显示放大的细胞内酸化恢复阶段。B净酸挤出绘制为类器官外围和核心区域pHi的函数从ErbB2诱导的小鼠乳腺癌组织中新鲜分离(n=6)。C在最大酸化过程中对应于初始pHi恢复阶段的固定pH i计算的净酸挤出(n=6)。

图5、用乙酰唑胺进行体内治疗可酸化小鼠ErbB2诱导的乳腺癌组织的微环境,降低乳酸浓度,并加速肿瘤生长。A)使用pH敏感微电极(n=8)进行的体内pH测量。“核心”被定义为在用电极逐步刺穿期间遇到的酸性最强的区域。在记录前30分钟,小鼠已接受腹膜内注射50 mg/kg乙酰唑胺(ATZ)或同等体积的载体。通过重复测量双向方差分析比较数据。B)示例性事后剖析肿瘤图像和体内ErbB2诱导的乳腺癌生长曲线,小鼠每天腹腔注射40 mg/kg ATZ与接受等体积载体的小鼠(n=17)相比。将数据拟合为二阶多项式函数,并通过额外的平方和F检验比较最佳拟合参数。比例尺代表5mm;两个图像都以相同的放大倍数显示。C-H)通过微透析评估的肿瘤糖酵解代谢。在ATZ或载体给药开始后1小时测量间质或血清[乳酸](C–E)和[葡萄糖](F–H)。
结论与展望
碳酸酐酶催化CO2/HCO3–缓冲反应,对有效的H+流动性、pH动力学和细胞酸碱感应有影响。然而碳酸酐酶对癌症和基质细胞功能、它们的相互作用和患者预后的综合影响尚不清楚。研究人员将人类蛋白质组学数据的生物信息学分析以及大量和单细胞转录组学数据与临床病理学和预后信息相结合,使用了unisense微电极系统的pH敏感微电极记录和基于微透析的代谢物分析,用于实验性诱发乳腺癌的小鼠肿瘤内的pH分布。乳腺癌是一种高度异质性的疾病。基于受体表达谱(例如,HER2/ErbB2、雌激素、黄体酮)的分层识别在潜在致癌机制和恶性行为中具有重叠特征的分子亚型。因此,这种分类为揭示疾病机制和阐明乳腺癌患者亚群之间可能存在差异的治疗结果提供了重要工具。本研究证明了碳酸酐酶有助于清除乳腺癌组织中的酸性代谢物,并且它们的抑制作用会增强肿瘤微环境的酸度。在小鼠ErbB2诱导的和人类HER2富集的乳腺癌中,细胞外碳酸酐酶增加免疫细胞浸润和细胞因子表达,减缓肿瘤生长,并提高存活率。
 相关新闻
相关新闻